
- •1.2.2. Первичная кристаллизация металла
- •1.2.3. Кристаллизация и строение металлического слитка
- •1.3. Порядок выполнения работы и обработка результатов
- •1.3.1. Изучение устройства и работы микроскопа amplival
- •1.3.2. Изучение процесса кристаллизации раствора азотнокислого свинца
- •1.4. Оформление отчета об исследовании
- •Исследование объёмной кристаллизации азотнокислого свинца
- •Исследование зональной кристаллизации азотнокислого свинца
- •1.5. Контрольные вопросы
Лабораторная работа № 1
ИЗУЧЕНИЕ ПРОЦЕССА КРИСТАЛЛИЗАЦИИ.
ЗАТВЕРДЕВАНИЕ КАПЛИ РАСТВОРА АЗОТНОКИСЛОГО СВИНЦА
1.1. Цель работы
Данная работа предполагает:
изучение атомно-кристаллической структуры металла;
изучение сущности процесса кристаллизации;
изучение кристаллического строения стального слитка;
изучение процесса кристаллизации на примере затвердевания капли
раствора азотнокислого свинца.
1.2. Основные положения
1.2.1. Кристаллическое строение металлов и сплавов
Металлы обладают ярко выраженными специфическими свойствами: высокой электро- и теплопроводностью, непрозрачностью, металлическим блеском, сочетанием высокой прочности и пластичности. Характерным свойством металлов является увеличение их электросопротивления с повышением температуры. Все специфические свойства металлов обусловлены атомным строением и типом связи между атомами.
Для металла характерно наличие атомно-кристаллической структуры, под которой понимают взаимное расположение атомов (ионов), расположенных в определенном порядке, который периодически повторяется в трех измерениях.
Типичным атомным строением металлов является наличие малого количества валентных электронов на внешней электронной оболочке. Валентные электроны слабо связаны с ядром, поэтому под воздействием внешних сил при затрате сравнительно небольшой энергии они могут покинуть свои орбиты. Чем меньше электронов находится на внешней оболочке, тем меньше необходимо затратить энергии для полного освобождения электрона от связи с ядром атома.
У большинства элементов периодической таблицы заполнение электронами новой квантовой оболочки начинается только после того, как полностью заполнится предыдущая квантовая оболочка. Однако, в таблице Д. И. Менделеева имеется группа элементов, у которых на наружной квантовой оболочке имеется 1…2 электрона при не полностью заполненной электронами внутренней квантовой оболочке. Такие элементы называются переходными металлами. К ним относятся титан, ванадий, хром, марганец, железо, кобальт, никель и др. Их свойства, такие как парамагнетизм, ферромагнетизм (железа, кобальта, никеля), способность образовывать соединения с углеродом (карбиды) и др., существенно зависят от степени заполнения электронами внутренних квантовых оболочек.
Одним из основополагающих моментов в процессе кристаллизации является тип существующей межатомной связи.
При сближении изолированных атомов внешние электронные оболочки начинают перекрываться и взаимодействовать между собой, в результате чего они изменяют свое строение. В зависимости от характера изменения строения валентных электронных оболочек различают четыре основных типа связи между атомами: ионную (гетерополярную), ковалентную (гомеополярную), полярную (связь Ван-дер-Ваальса) и металлическую.
Характерной особенностью ионной, ковалентной и полярной связей является наличие направленных сил связи между отдельными атомами. При направленной связи каждый атом объединяется только с определенными атомами.
Металлический тип связи осуществляется между атомами (в жидких и твердых металлах), когда число валентных электронов в атоме мало. В этом случае свободных электронных оболочек имеется значительно больше, чем электронов для их заполнения. Поэтому при перекрытии внешних электронных оболочек электроны отрываются от своих атомов и свободно перемещаются в различных направлениях по незанятым электронным оболочкам между положительно ионизированными атомами (ионами), образуя вокруг них свободный, так называемый, электронный газ. Между положительными ионами и свободным электронным газом возникают силы электростатического взаимопритяжения, которые и обуславливают металлический тип связи между атомами.
В отличие от других межатомных связей металлический тип характеризуется отсутствием направленных сил связи между атомами. Поэтому смещение атомов друг относительно друга под воздействием внешних сил не приводит к уничтожению межатомных сил связи, так как наличие свободного электронного газа обеспечивает межатомную связь и в новом положении атомов. Следовательно, отсутствием направленных связей между атомами объясняется высокая пластичность металлов и металлических сплавов.
При наличии направленных сил связей смещение атомов друг относительно друга под воздействием внешних сил приводит к уничтожению связи между атомами, т.е. к разрушению без пластической деформации. Наличие свободных электронов и электронных оболочек обуславливает также высокую электро- и теплопроводность металлов и металлических сплавов.
Все металлы и металлические сплавы являются телами кристаллическими. В отличие от аморфных тел в кристаллическом теле атомы (также положительные ионы) располагаются в строго определенном порядке и в пространстве образуют так называемую кристаллическую решетку. Атомы в кристаллической решетке стремятся расположиться по возможности плотнее (ближе) друг к другу. Каждый атом в кристаллической решетке находится в одинаковом окружении, т.е. имеет вокруг себя одинаковое количество атомов, находящихся на равном расстоянии.
Металлический тип связи, отсутствие направленных связей между атомами и возможность каждого атома в кристаллической решетке находиться в тесном контакте со всеми окружающими его ближайшими соседними атомами позволяют у металлов получать наиболее плотное расположение атомов в кристаллической решетке. Переход электронов от одного атома к другому осуществляется тем реже, чем плотнее атомы прилегают друг к другу.
Согласно электронной теории строения металлов отметим, что различные составляющие энергии кристалла, связанного силами металлической связи, можно записать в виде выражения:
![]() (1.
1)
(1.
1)
где атомный объем (объем, приходящийся на один атом). Первый член этого выражения представляет собой потенциальную энергию свободных электронов, второй член их кинетическую энергию, а третий член кинетическую энергию электронов, занимающих более низкие энергетические состояния. Сумма этих трех составляющих дает результирующую кривую распределения энергии, представленную на рис. 1.1, где минимум энергии соответствует линейному размеру ro, который можно рассматривать как атомный радиус, соответствующий следующему равенству: (4/3)ro3 = . Энергия Е представляет собой работу, необходимую для того, чтобы перевести металлический кристалл в газ из положительно заряженных ионов.
Металлический тип связи, возникающий между положительно заряженными ионами и валентными (отрицательно заряженными) электронами, обуславливает появление сил, удерживающих атомы (ионы, молекулы) в узлах кристаллической решетки на определенном расстоянии друг от друга. Эти силы складываются из сил притяжения и отталкивания. Равновесному состоянию соответствует такое состояние, когда суммарная энергия взаимодействия сил притяжения и отталкивания является минимальной. В этом случае расстояние между атомами (ионами) одинаково и атомы располагаются закономерно, образуя правильную кристаллическую решетку. Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узлах которой располагаются атомы (ионы), образующие твердое кристаллическое тело, в данном случае металл. Наименьший объём кристалла, дающий представление об атомной структуре металла во всем объёме, получил название элементарной кристаллической решетки (ячейки). Другими словами, под элементарной кристаллической решеткой подразумевается комплекс атомов, который при своем многократном повторении в пространстве позволяет воспроизводить пространственную кристаллическую решётку.

![]()
![]()



![]()
![]()
Рис. 1.1. Зависимость полной энергии металла от межатомного расстояния
Метод изображения кристаллической решетки в виде различных мно-гогранников является условным. Более правильным является представление атомов в кристаллической решетке в виде соприкасающихся шаров, рис. 1.2.
Строение и свойства кристаллических решеток характеризуется следующими параметрами:
1)
периодом решетки “а”. Периодом решетки
называется расстояние между центрами
соседних атомов, находящихся в узлах
кристаллической решетки. Период решетки
принято измерять в ангстремах или
нанометрах (нм) (1 нм = 10-9
см = 0,1![]() );
);
2) координационным числом, показывающим, сколько атомов находится на наиболее близком и равном расстоянии от любого выбранного атома. Координационное число характеризует взаимную связь атомов друг от друга;
3) базисом кристаллической решетки, то есть числом атомов, приходящихся на одну элементарную ячейку. Базис характеризует плотность решетки.
В каждой решетке, кроме объема, занимаемого атомами, остается еще свободное пространство (пустота). Отношение объема, занимаемого атомами, ко всему объему решетки называется коэффициентом компактности. Чем больше коэффициент компактности, тем теснее уложены атомы в решетке (больше плотность) и тем легче будет осуществляться связь в ре-шетке между атомами, то есть легче осуществляется переход валентных электронов от одного атома к другому.
Большинство металлов и сплавов кристаллизуется с образованием одной из следующих элементарных кристаллических решеток: объёмно-центрированной кубической, гранецентрированной кубической и гексагональной плотноупакованной, рис. 2.2.
|
|
|
Рис.1.2 Элементарные кристаллические решетки металлов и схемы упаковки атомов:
а объемно-центрированная кубическая (о.ц.к); б гранецентрированная кубическая (г.ц.к);
в гексагональная плотноупакованная (г.п.у).
а)
Кубическая объёмно-центрированная
решётка (К8), с координационным числом
8 и базисом, равным 2 атомам. В ней каждый
атом, находящийся в вершине куба,
принадлежит одновременно 8 ячейкам.
Атом, находящийся внутри кристаллической
решётки, принадлежит только одной
элементарной ячейке. Таким образом,
только (1/8)8+1=2
атома на каждую объемно-центрированную
решетку. Кубическая решетка определяется
одним периодом
длиной ребра куба “а”, которая колеблется
от 2,68 до 6,07 А. Наименьшее расстояние
между атомами, выраженное через период
решетки “а”, равно (а/2)![]() .
Коэффициент компактности 0,68 или 68.
Решетку К8 имеют металлы: Fe();
Mo; W; V; Cr; Nb; Ti();
Ta; Li; H; Na и др.
.
Коэффициент компактности 0,68 или 68.
Решетку К8 имеют металлы: Fe();
Mo; W; V; Cr; Nb; Ti();
Ta; Li; H; Na и др.
б)
Кубическая гранецентрированная решетка
(К12) с координационным числом 12 и базисом,
равным 4 атомам (1/8)8
= 1 атом от числа атомов, расположенных
в вершинах куба (1/2)6
= 3 атомам от числа атомов, находящихся
в центре граней куба. Наименьшее
расстояние между атомами, выраженное
через период решетки “а”, равно (а
2)![]() .
Коэффициент компактности 0,74 или 74%.
Решётку К12 имеют металлы: Fe ();
Cu; Ni; Al; Co();
Pt; Ag; Au и др.
.
Коэффициент компактности 0,74 или 74%.
Решётку К12 имеют металлы: Fe ();
Cu; Ni; Al; Co();
Pt; Ag; Au и др.
в) Гексагональная плотноупакованная решётка (Г12), которую определяют два периода “с” и “а”. Период “а” колеблется от 2,28 до 3,38 А, период “с” от 3,57 до 6,52. Решётка Г12 характеризуется отношением периодов решетки с/а. Если это отношение равно или близко к 1,633, то получим гексагональную плотноупакованную решётку с координационным числом 12 и базисом, равным 6 атомам (1/6)12 = 2 атомам от числа атомов, расположенных в вершинах шестигранника, (1/2) 2 = 1 атом от числа атомов, находящихся в центре шестигранника, плюс 3 атома, имеющихся внутри кристаллической ячейки. Коэффициент компактности 0,74 или 74%. Решётку Г12 имеют металлы: Ti(); Co(); Be; Mg; Rn; Re; Os.
Если отношение а/с будет сильно отличаться от величины 1,633, то получим гексагональную не плотноупакованную решетку с координационным числом 6 и коэффициентом компактности 0,5 или 50%. Обозначается она индексом Г6. Такую решетку имеет цинк, кадмий, ртуть, графит.
Правильное расположение атомов в монокристаллах обуславливает неодинаковую плотность заполнения атомами различных кристаллографических плоскостей и направлений. Многие свойства зависят от выбранного направления вырезки образца по отношению к направлениям в решетке, то есть то того, насколько плотно располагаются атомы в направлении, вдоль которого ведется измерение. Подобная неоднородность свойств монокристалла в разных кристаллографических направлениях называется анизотропией.
Аморфные тела (стекло, пластмассы и др.), свойства которых не зависят от направлений, называют изотропными.
Реальные металлы и сплавы состоят не из одного монокристалла, а из большего числа кристаллов, различно ориентированных в пространстве. Такое тело называется поликристаллическим. Кристаллы поликристаллического тела, имеющие неправильную форму, носят название зерен или кристаллитов. Несмотря на внутренние дефекты отдельных зерен, каждое из них обладает свойством анизотропии. Свойства реальных поликристаллических тел, вследствие произвольного расположения каждого из зерен, будут в различных направлениях примерно одинаковыми. Это явление называется квазиизотропией (ложной изотропией).
1.2.2. Первичная кристаллизация металла
Любое вещество может находиться в четырех агрегатных состояниях: твердом, жидком, газообразном и плазменном. Переход из одного агрегатного состояния в другое называется фазовым превращением.
Кристаллизацией называется процесс образования кристаллов (образование кристаллической решетки) из жидкой или газообразных фаз.
Самопроизвольно (спонтанно) в природе могут происходить лишь те процессы, которые сопровождаются уменьшением свободной энергии системы. Свободная энергия F может быть определена как сумма кинетической и потенциальной энергий частиц. Энергия F называется свободной, поскольку при изотермических процессах она может быть выделена из системы в виде тепла и превращена в работу. Изменение свободной энергии жидкого и твердого состояний в зависимости от температуры приведена на рис. 1.3.
Температура ТS теоретическая или равновесная температура, при которой ни процесс кристаллизации, ни процесс плавления до конца идти не могут. Для развития процесса кристаллизации необходимо создать такие условия, при которых свободная энергия твердой фазы будет меньше, чем свободная энергия жидкой фазы. Как видно из графика на рис. 1.3, это возможно только при некотором переохлаждении металла.
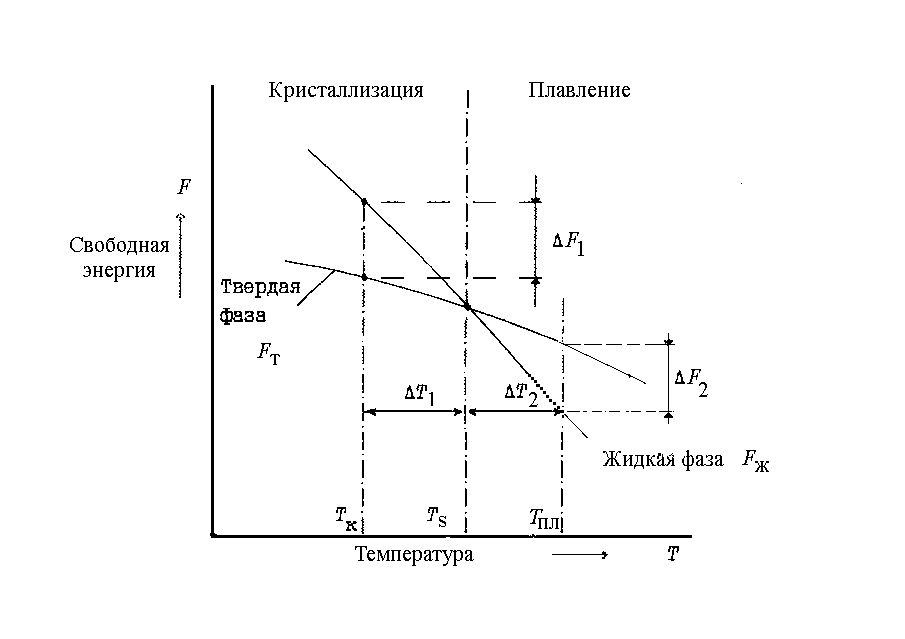 Рис.
1.3. Изменение свободной энергии металла
в жидком и твердом состоянии в зависимости
от температуры
Рис.
1.3. Изменение свободной энергии металла
в жидком и твердом состоянии в зависимости
от температуры
Степенью переохлаждения Т называется разность между теоретической и фактической температурами кристаллизации:
![]() или
или
![]() (1.2)
(1.2)
где Ткр фактическая температура кристаллизации; Тпл фактическая температура плавления.
Степень переохлаждения зависит от скорости охлаждения (чем больше скорость охлаждения, тем больше степень переохлаждения), природы и чистоты расплава. Чем чище расплав, тем больше его устойчивость и, следовательно, больше степень переохлаждения.
Наличие нерастворенных частичек ускоряет процесс кристаллизации, уменьшает степень переохлаждения и измельчает зерно. У металлов и сплавов способность к переохлаждению невелика и изменяется от сотых долей градуса до десятков градусов. Наибольшую степень переохлаждения имеет сурьма (31С). Процесс кристаллизации изучают по кривым охлаждения рис. 1.4.
Р ис.
1.4 Варианты кривых охлаждения при
кристаллизации
ис.
1.4 Варианты кривых охлаждения при
кристаллизации
Охлаждение металла в жидком состоянии сопровождается плавным понижением температуры и может быть названо простым охлаждением, так как в этот момент нет качественного изменения состояния. При достижении температуры кристаллизации появляется горизонтальная площадка, т.к. отвод тепла компенсируется выделяющейся при кристаллизации скрытой теплотой кристаллизации. После полного перехода в твердое состояние температура снова начинает снижаться, и твердое кристаллическое вещество охлаждается. Кривая 1 соответствует теоретическому процессу кристаллизации, кривая 2 показывает реальный процесс кристаллизации. Кривая 3 характерна для металлов, у которых из-за большого переохлаждения скрытая теплота выделяется скачкообразно в начальный момент кристаллизации.
В общем случае, чем больше скорость охлаждения, тем при более низкой температуре заканчивается процесс кристаллизации и тем больше будет степень переохлаждения.
Крупнейший русский ученый Д. К. Чернов, изучая структуру литой стали, указал, что процесс кристаллизации протекает путем образования зародышей и последующего их роста, следовательно, процесс кристаллизации складывается из двух элементарных процессов:
1) скорости зарождения центров кристаллизации (скоростью зарождения центров кристаллизации называется количество зародышей, возникающих в единице объема за единицу времени, и имеет размерность 1/мм3с; 1/см3с и т.д.);
2) скорости ростов кристаллов (скоростью роста кристаллов называется скорость увеличения линейных размеров растущей грани кристалла в единицу времени и имеет размерность мм/с; см/с и т.д.).
Исследования последних лет показали, что расплавленный металл, близкий к моменту кристаллизации, проявляет некоторые признаки упорядоченного строения, присущего кристаллическому телу. В жидкости создаются группировки атомов (очень малых размеров), которые способны при определенных условиях образовывать зародыши. Энергия этих группировок атомов будет неодинакова. Группировки, обладающие энергией, меньшей чем средняя величина, будут обладать и меньшей температурой. В этих участках жидкости и возникает первый зародыш центр кристаллизации. Случайные и временные отклонения энергии отдельных группировок от среднего значения для данной температуры называются флуктуациями энергии. Флуктуация энергии и является причиной возникновения зародышей.
Энергетическая флуктуация, приводящая к образованию новой фазы, называется гетерофазной флуктуацией.
В процессе кристаллизации могут возникнуть зародыши различной величины, однако не все зародыши будут способны к росту. К росту способны только те зародыши, рост которых будет вести к уменьшению свободной энергии системы. Образование зародыша вызывает изменение свободной энергии системы, которое выражается в следующем виде:
F = V (FТ FЖ ) + S , (1.3)
где V объем зародыша; FТ свободная энергия единицы объема образовавшегося зародыша; FЖ свободная энергия единицы объема жидкого сплава; S поверхность зародыша; коэффициент поверхностного натяжение на границе раздела между жидким сплавом и образовавшимся зародышем.
Из этой формулы видно, что при образовании и росте зародышей свободная энергия системы (единицы объема) изменяется в двух противоположных направлениях. Во-первых, образование зародыша с меньшим запасом свободной энергии ведет к уменьшению свободной энергии системы. Во-вторых, образование границы раздела между жидким и твердым сплавом ведет к увеличению свободной энергии системы, так как атомы, находящиеся на поверхности кристалла, обладают более высокой потенциальной энергией, чем атомы, находящиеся внутри кристаллической решетки. Следовательно, для образования поверхности раздела необходимо затратить некоторую энергию. Чем меньше кристаллический зародыш, тем больше поверхности раздела приходится на единицу объема и тем больше суммарная свободная энергия системы. Только после достижения определенного размера зародыша суммарная энергия системы начнет убывать. Такой зародыш называется критическим или равновесным. Все зародыши больше критического называются устойчивыми, способными к росту, т.к. их рост ведет к уменьшению свободной энергии системы. Размер критического зародыша зависит от степени переохлаждения. Чем больше степень переохлаждения, тем меньше размер критического зародыша.
Форма растущих кристаллов при условии равномерного охлаждения в первый момент кристаллизации, когда кристаллы окружены жидкостью, будет геометрически правильная, соответствующая их кристаллическому строению. При взаимном столкновении кристаллов их правильная форма нарушается и становится в момент окончания процесса кристаллизации неправильной. Такие кристаллы называются зернами или кристаллитами.
Образование зародыша происходит легче на готовой подкладке. Рост зародыша происходит не за счет отдельных атомов, а путем наслоения на растущую грань атомной плоскости, размером не менее критического зародыша. Число центров кристаллизации и скорость их роста зависят от степени переохлаждения, рис.1.5. С увеличением степени переохлаждения возрастает число центров кристаллизации (рис.1.5., поз.1) и скорость роста кристаллов (рис.1.5., поз.2), при определенной степени переохлаждения наступает максимум. Однако металлы и сплавы, обладающие в жидком состоянии малой склонностью к переохлаждению, невозможно охладить до таких температур, при которых число центров кристаллизации и скорость роста кристаллов достигли бы максимума. Поэтому для металлических сплавов кривые числа центров кристаллизации и скорости роста кристаллов обрываются уже при значительных степенях переохлаждения.
Для степени переохлаждения Т1 скорость роста кристаллов велика, а скорость образования центров кристаллизации мала. В силу этого обстоятельства зерна получаются крупные.
Для степени переохлаждения Т2 число центров кристаллизации возросло значительно больше, чем скорость их роста, поэтому получаются мелкие зерна. Увеличение числа центров кристаллизации и скорости роста кристаллов с увеличением степени переохлаждения объясняются уменьшением размера минимального зародыша, способного к росту (критического).

Рис. 1.5. Зависимость скорости зарождения центров кристаллизации и средней скорости их роста от степени переохлаждения
Количество кристаллов (зёрен) n при данной степени переохлаждения может быть определено по следующей формуле:
n = (Ч.Ц. С.Р.)1/2, (1.4)
где Ч.Ц. число центров кристаллизации; С.Р. скорость роста центров кристаллизации.
Величина зерна d находится в следующей зависимости от числа центров кристаллизации и скорости их роста:
d = 1,1 (C.P. Ч.Ц.)3/4. (1.5)
Таким образом, изменяя степень переохлаждения, можно получить кристаллиты (зерна) различной величины. От величины зерна зависят многие свойства металлов.
На практике измельчение зерна в металле достигается путем модифицирования, т.е. путем введения в расплав дисперсных частичек, являющихся дополнительными центрами кристаллизации.
В зависимости от условий охлаждения, характера и количества примесей в расплаве форма и размер получаемых кристаллитов могут быть самые разнообразные. При кристаллизации металлов и их сплавов чаще всего получаются так называемые дендритные кристаллы. Дендриты или древовидные кристаллы можно видеть на поверхности слитков. Кристаллы дендритной формы часто можно наблюдать в усадочной раковине. Рост дендрита происходит путем образования осей первого порядка (стволы), перпендикулярно которым вырастают ветви второго порядка, перпендикулярно к ним третьего порядка и т.д.
Рост ветвей первого порядка происходит в направлении максимальной линейной скорости роста и определяется главным образом направлением отвода тепла.



