
- •1. Предмет коллоидной химии
- •2. Основы термодинамики поверхностных явлений
- •2.1. Общая характеристика поверхностной энергии
- •2.1.1. Поверхностная энергия и поверхностное натяжение
- •6. Электрические явления на поверхностях
- •6.3. Формулы дэс (строение мицелл)
- •6. Электрические явления на поверхностях
- •6.4. Электрокинетические явления
- •7. Агрегативная устойчивость и коагуляция дисперсных систем
- •7.1. Седиментационная и агрегативная устойчивость
- •7. Агрегативная устойчивость и коагуляция дисперсных систем
- •7.2. Лиофильные дисперсные системы
- •7.2.1. Классификация и общая характеристика поверхностно активных веществ (пав)
- •7. Агрегативная устойчивость и коагуляция дисперсных систем
- •7.2. Лиофильные дисперсные системы
- •7.2.2. Мицеллообразование в растворах пав, солюбилизация
- •7.2. Лиофильные дисперсные системы
- •7.2.3. Критическая концентрация мицеллообразования (ккм)
- •7. Агрегативная устойчивость и коагуляция дисперсных систем
- •7.3. Лиофобные дисперсные системы
- •7.3.1. Факторы устойчивости лиофобных систем
- •7. Агрегативная устойчивость и коагуляция дисперсных систем
- •7.3. Лиофобные дисперсные системы
- •7.3.3. Быстрая коагуляция, уравнение Смолуховского
- •7. Агрегативная устойчивость и коагуляция дисперсных систем
- •7.3. Лиофобные дисперсные системы
- •7.3.4. Электролитная коагуляция
- •8. Структурно-механические свойства дисперсных систем
- •8.1. Механизм структурообразования в дисперсных системах
|
||||
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И ДИСПЕРСНЫЕ СИСТЕМЫ (Коллоидная химия) Тестовые задания для самоконтроля
|
||||
© Кафедра коллоидной химии. |
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И ДИСПЕРСНЫЕ СИСТЕМЫ
(Коллоидная химия)
Тестовые задания для самоконтроля
1. Предмет коллоидной химии
К числу поверхностных относятся явления, происходящие
внутри отдельной фазы
в объеме истинного раствора
в газовой системе
на границе раздела фаз
Из перечисленных явлений относятся к поверхностным явлениям
седиментация
смачивание
мицеллообразование
абсорбция
электрофорез
адсорбция
адгезия
коагуляция
Удельная поверхность дисперсной системы - это отношение площади поверхности между фазами
к температуре
к давлению
к объему дисперсной фазы
к концентрации дисперсной фазы
к массе дисперсной фазы
к концентрации дисперсионной среды
Дисперсная фаза состоит из сферических частиц радиусом (r). Дисперсность D=
1/r
2/r
1/(2r)
4/r
Вид зависимости удельной поверхности (Sуд) от дисперсности (D)
1.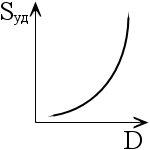 2.
2. 3.
3.
 4.
4.

Вид зависимости удельной поверхности (Sуд) от размера частиц (а)
1. 2. 3.
Размер частиц золей (ультрамикрогетерогенных систем) лежит в пределах
от 10-11 до 10-12 м
от 10-8 до 10-10 м
от 10-5 до 10-7 м
от 10-7 до 10-9 м
от 10-3 до 10-5 м
от 10-1 до 10-2 м
Лиозоли, согласно классификации дисперсных систем по размерам частиц дисперсной фазы, относят к
микрогетерогенным системам
ультрамикрогетерогенным системам
грубодисперсным системам
Суспензии, согласно классификации дисперсных систем по размерам частиц дисперсной фазы, относят к
грубодисперсным системам
микрогетерогенным системам
ультрамикрогетерогенным системам
Характерными особенностями лиозолей являются
низкое поверхностное натяжение
отсутствие седиментации
наличие структуры
участие частиц в броуновском движении
высокая вязкость
2. Основы термодинамики поверхностных явлений
2.1. Общая характеристика поверхностной энергии
2.1.1. Поверхностная энергия и поверхностное натяжение
Поверхностная энергия, которой обладают объекты коллоидной химии, представляет собой
произведение поверхностного натяжения и температуры
произведение поверхностного натяжения и давления
произведение поверхностного натяжения и площади межфазной поверхности
отношение поверхностного натяжения к площади межфазной поверхности
Поверхностное натяжение – это частная производная от любого термодинамического потенциала
по числу молей дисперсной фазы
по площади межфазной поверхности
по температуре
по давлению
Поверхностное натяжение жидкостей представляет собой
внутреннюю энергию единицы поверхностного слоя
теплоту образования единицы поверхности
удельную свободную энергию
G – энергия Гиббса; S – энтропия; Т – температура; V – объем; р – давление; σ – поверхностное натяжение; s – площадь поверхности; μi – химический потенциал компонента i; ni – число молей компонента i; φ и q – электрический потенциал и заряд поверхности.
Объединенное уравнение первого и второго начал термодинамики для дисперсных систем dG =
SdT + Vdp + σds + ∑μidni + φdq
SdT + Vdp – σds + ∑μidni + φdq
SdT + Vdp + ∑μidni + φdq
U - внутренняя энергия; S – энтропия; Т – температура; V – объем; р – давление; σ – поверхностное натяжение; s – площадь поверхности; μi – химический потенциал компонента i; ni – число молей компонента i; φ и q – электрический потенциал и заряд поверхности.
Объединенное уравнение первого и второго начал термодинамики для дисперсных систем dU =
TdS – pdV + ∑μidni + φdq
TdS – pdV + σds + ∑μidni + φdq
TdS – pdV – ∑μidni + φdq
Единицы измерения величины поверхностного натяжения
Дж
Н/м2
Дж·м2
Н/м
Дж/моль
Дж/м2
U – внутренняя энергия; G – энергия Гиббса; S – энтропия; n – число молей вещества; s – площадь поверхности; V – объем; Т – температура.
Варианты выражений термодинамического определения поверхностного натяжения σ=
1. 2.
2.
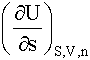 3.
3.
 4.
4.

G – энергия Гиббса; F – энергия Гельмгольца; n – число молей вещества; s – площадь поверхности; V – объем; Т – температура.
Варианты выражений термодинамического определения поверхностного натяжения σ=
1.
2. 3.
3. 4.
4.
Верные сравнения поверхностных натяжений (σ) веществ, находящихся в различном агрегатном состоянии
σлед-воздух > σвода-воздух
σж1-ж2 < σж1-г
σвода-воздух > σртуть-воздух
Верные сравнения поверхностных натяжений (σ) жидкостей на границе с газовой фазой (воздухом) при одинаковой температуре
σоктан > σвода
σртуть > σsвода
σэтанол > σвода
σвода > σизопропанол
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И ДИСПЕРСНЫЕ СИСТЕМЫ
(Коллоидная химия)
Тестовые задания для самоконтроля

