
- •2) Молекули в будь-якій речовині безперервно і хаотично (безладно) рухаються;
- •Домашнє завдання.
- •Задачі на самостійну роботу.
- •Задачі на самостійну роботу.
- •1.Визначаю ціну поділки манометра.
- •2.Визначаю початкові параметри досліджуваного газу та значення константи.
- •3.Провожу дослід з використанням холодної води і визначаю параметри та значення константи.
- •5. Визначаю середнє значення константи
- •6. Визначаю відносну похибку
- •Робота чисельно рівна площі обмеженій графіком.
- •16. Ккд теплового двигуна
- •7. Властивості випаровування
- •9. Випаровування і конденсація відбуваються одночасно.
- •21. Умова кипіння
- •29.Вимірюють відносну вологість гігрометрами та психрометрами.
- •Контрольні питання.
- •2. Рідини мають такі властивості:
- •4. Коефіцієнт поверхневого натягу:
- •5. Коефіцієнт поверхневого натягу σ залежить від:
- •6. Способи визначення коефіцієнта поверхневого натягу:
- •14. Прояви та використання капілярності
- •Домашнє завдання.
- •Домашнє завдання.
- •Деформація — це зміна форми або об'єму тіла.
- •Закон пружних деформацій — закон Гука
- •Механічні властивості твердих тіл
- •Зміна зовнішнього тиску впливає на температуру плавлення.
- •Всі речовини при нагріванні розширюються, а при охолодженні стискуються.
- •Довжину тіла, при різних температурах визначають:
- •4. Алюміній – 2,3 ·10-5 к-1 4. Вода : від 1,5·10-4 к-1 до 7·10-4 к-1
Заняття № 17 ____________2012 р. Тема: Основні положення МКТ.
Основні положення МКТ. Дифузія. Сили міжмолекулярної взаємодії. Кінетична і потенціальні енергії молекул. Агрегатний стан речовини .Броунівський рух. Характеристика газоподібного стану. Ідеальний газ. Моль. Молярна маса. Постійна Авогадро. Маса молекули. Кількість речовини. Густина речовини. Концентрація. Молярний об’єм за нормальних умов. Основне рівняння МКТ. Манометри. Температура. Вимірювання температури. Абсолютна температура та її зв'язок з енергією. Абсолютний нуль. Зв'язок між температурою і кінетичною енергією молекул. .
Основні положення та означення.
1. Будь-яка речовина складається з молекул (від латинського молес» — маса, «кула» — зменшувальний суфікс). Молекулою називають найменшу частинку речовини, яка здатна самостійно існувати і зберігати хімічні властивості цієї речовини.
2. Молекули складаються з атомів (від грецьк. слова «атомос» — неподільний);
3.Речовини, які не можна розкласти на простіші складові, називаються хімічними елементами.
4. Основні положення молекулярно-кінетичної теорії:
1) усі види речовини складаються з молекул, між якими є міжмолекулярні проміжки;
2) Молекули в будь-якій речовині безперервно і хаотично (безладно) рухаються;
3) на невеликих відстанях між молекулами (атомами) діють як сили притягання, так і сили відштовхування; природа цих сил електромагнітна.
5. Дифузія (від латинського «дифузіо» — розтікання) – процес вирівнювання концентрації молекул якоїсь речовини в просторі, зумовлений хаотичним рухом молекул.
( У рідинах дифузія відбувається значно повільніше, ніж у газах. У твердих тілах дифузія відбувається дуже повільно.)
6![]() .
Найменша
відстань між молекулами,
на якій сили взаємодії молекул такі
малі, що ними можна знехтувати,
називається
радіусом
молекулярної дії.
(Він
становить близько одного нанометра
(нм), тобто мільярдної частки метра
(1 нм = 10-9м)).
.
Найменша
відстань між молекулами,
на якій сили взаємодії молекул такі
малі, що ними можна знехтувати,
називається
радіусом
молекулярної дії.
(Він
становить близько одного нанометра
(нм), тобто мільярдної частки метра
(1 нм = 10-9м)).
7.Кінетична енергія поступального руху молекули
8. Вважатимемо, що потенціальна енергія відокремленої молекули, яка не взаємодіє з іншими молекулами, дорівнює нулю
9. Вивчення властивостей речовини показало, що та сама речовина може бути в твердому, рідкому, газоподібному станах, які часто називають агрегатними станами.
Якщо молекули тільки коливаються навколо своїх середніх положень ( положень рівноваги) то речовина залишається в твердому стані.
Коли внаслідок нагрівання тіла енергія Епост збільшується то речовина переходить у рідкий стан: молекули продовжують коливатися, але багато молекул переходить у нове положення: речовина набуває текучості.
При дальшому збільшенні температури тіла сили молекулярної взаємодії не можуть утримати молекули одну поблизу від одної, і вони розлітаються по всьому наданому їм простору, тобто речовина переходить у газоподібний стан.
Отже, якщо Епост <<Пмін, то речовина тверда; якщо Епост≈Пмін, то речовина рідка; якщо Епост >>Пмін, то речовина газоподібна.
10. Величину, яка характеризує ступінь нагрітості тіла, називають температурою цього тіла.
Для об'єктивного вимірювання температури було створено спеціальний прилад, який назвали т є р м о м є т р о м.
11.Сума кінетичної і потенціальної енергій всіх частинок тіла називається внутрішньою енергією цього тіла. Систему тіл, внутрішня енергія якої стала, називають замкненою або ізольованою системою.
12. Рух пилинок, зумовлений ударами молекул, які рухаються хаотично, називається броунівським рухом.
(Молекули газу рухаються рівномірно і прямолінійно (за інерцією), поки не зіткнуться з іншими молекулами (або із стінками посудини). Під час зіткнення змінюються величина і напрям швидкості руху молекули, і молекула рухається з новою сталою швидкістю до наступного зіткнення.)
13. Ідеальним газом називають газ молекули якого є матеріальними точками з деякими масами, що рухаються хаотично не взаємодіючи між собою. ( Всі реальні гази при невеликих тисках і низьких температурах описуються простим спільним законом, який є справедливим лише для ідеального газу.)
14. Атомною одиницею маси називається 1/12 маси ізотопу вуглецю 12С, скорочене найменування — а. о. м.
15. Маса молекули (атома), виражена в атомних одиницях маси, називається відносною молекулярною (атомною) масою. Вона показує, у скільки разів маса молекули речовини більша за 1/12 маси ізотопу вуглецю 12С.
1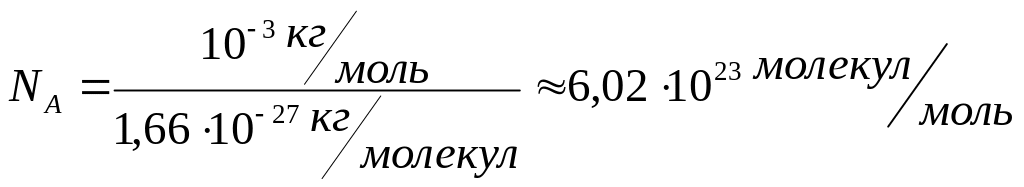 6
.Молем
називають
кількість
речовин,
маса якої в грамах дорівнює її відносній
молекулярній масі (mвід)-
М
=
mвідн
[г/моль] = mвідн
[кг/моль].
6
.Молем
називають
кількість
речовин,
маса якої в грамах дорівнює її відносній
молекулярній масі (mвід)-
М
=
mвідн
[г/моль] = mвідн
[кг/моль].
17. Kількість молекул у молі будь-якої речовини однакова. Кількість молекул в одному молі речовини називається сталою Авогадро.( позначається NА.
одиниця вимірювання - моль у мінус першому степені (моль-1))
В загальному випадку молем називається кількість речовини (у вигляді структурних елементів якогось певного роду), маса якої в грамах дорівнює відносній масі даного структурного елемента.. Часто користуються поняттям кіломоля (кмоль) речовини: 1 кмоль = = 1000 молів.
18. Один моль будь-якого газу за нормальних умов має об'єм 22,4 • 10-3 м3, або 22,4 л.
19. закон Авогадро:в рівних об'ємах різних газів при однаковому тиску і температурі міститься однакове число молекул,
20.
Густиною
тіла (речовини
)
називають
фізичну величину яка показує масу
тіла в одиниці
його об’єму
і визначається відношенням маси тіла
до його об’єму.
-![]()
( позначається літерою – ρ, одиниця вимірювання – кілограм поділено на метр кубічний (кг/м3))
21.
Концентрація
– фізична
величина яка показує кількість
в одиниці об’єму
і визначається відношенням кількості
до одиниці об’єму. -
![]() ( позначається
літерою –
( позначається
літерою –
![]() ,
одиниця вимірювання – метр у мінус
третій степені (м-3))
,
одиниця вимірювання – метр у мінус
третій степені (м-3))
22.Тиск в газах визначається ударами молекул об стінки посудини. Очевидно, що чим більше буде ударів за одиницю часу тим більшим буде тиск.
23.Рівняння
![]() називають основним
рівнянням МКТ.
Із основного рівняння МКТ слідує: що
величина
тиску
газу визначається його концентрацією
та середньоквадратичною
швидкістю
руху молекул.
Тиск газу буде рівний нулю лише за умови
рівності нулю швидкостей його молекул
називають основним
рівнянням МКТ.
Із основного рівняння МКТ слідує: що
величина
тиску
газу визначається його концентрацією
та середньоквадратичною
швидкістю
руху молекул.
Тиск газу буде рівний нулю лише за умови
рівності нулю швидкостей його молекул
24.
Ще
один вираз основного рівняння МКТ
![]()
тиск газу прямо пропорційний середній кінетичній енергії поступального руху молекул газу і їх числу в одиниці об’єму
25.Одиниця
тиску :
![]()
У СІ за одиницю тиску беруть паскаль (Па). Тиск, при якому на площу в 1 м2 діє сила тиску в 1 Н, називається паскалем.
На практиці використовують ще й інші одиниці тиску: технічну атмосферу, міліметр ртутного стовпа, фізичну атмосферу.
М![]() іліметром
ртутного стовпа (мм рт. сі.) називається
тиск, який чинить стовп ртуті висотою
в 1 мм на горизонтальну поверхню. Оскільки
тиск всередині рідини на глибині h,
зумовлений
її вагою, визначають за формулою
іліметром
ртутного стовпа (мм рт. сі.) називається
тиск, який чинить стовп ртуті висотою
в 1 мм на горизонтальну поверхню. Оскільки
тиск всередині рідини на глибині h,
зумовлений
її вагою, визначають за формулою![]()
то легко встановити таке співвідношення:
Нормальним тиском вважають тиск Р= 101325 Па
Під температурою вважатимемо фізичну величину яка характеризує міру нагрітості тіла. На території України найбільш поширеною шкалою для вимірювання температури є шкала Цельсія. Шкала температур, установлена за водневим термометром, в якій 0° відповідає температурі танення льоду, а 100°— температурі кипіння води, називають шкалою Цельсія.
Таку температуру позначають літерою t і вимірюють в градусах Цельсія ( 0С)
Температура, при якій має припинитися поступальний рух молекул , називається абсолютним нулем. Теоретично встановлено, що абсолютному нулю за шкалою Цельсія відповідає температура t= - 273,15 0С. Температури, нижчої від абсолютного нуля, в природі не може бути.
Температуру тіла можливо як завгодно близько наближати до абсолютного нуля, але досягнути його неможливо.
За пропозицією Кельвіна було введено температурну шкалу, яку тепер називають термодинамічною шкалою температур. Іноді її називають шкалою Кельвіна. На цій шкалі за початок відліку береться температура абсолютного нуля, а розмір градуса визначають так, щоб він якомога точніше збігався з градусом. Цельсія.
Температура, виражена в кельвінах (К), за термодинамічною шкалою, називається абсолютною, її позначають Т. Зв'язок між абсолютною температурою і температурою за 100-градусною шкалою виражається так Т = 273,15+ t. або Т = 273 + t.
У СІ одиниця температури є основною. Абсолютна температура не може бути від'ємною.
Нормальною вважатимемо температуру t=00С, або Т=273К.
З формули
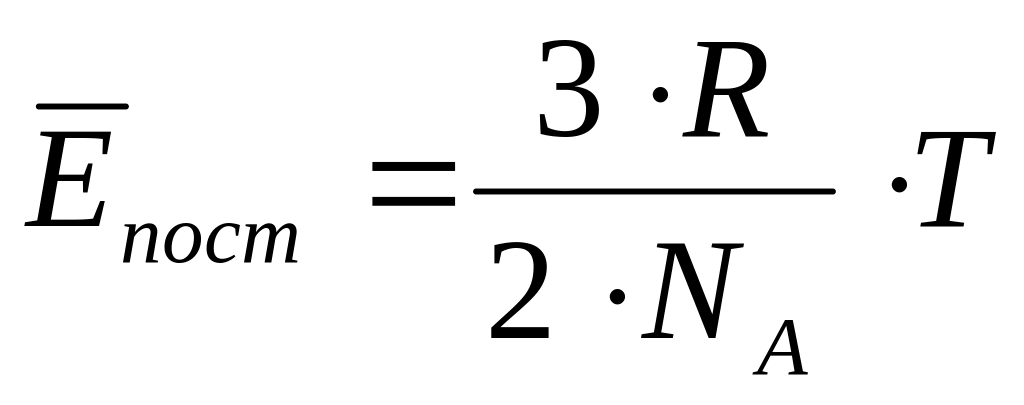 випливає, що
середнє
значення кінетичної енергії поступального
руху молекул не залежить від природи
газу, а визначається тільки його
температурою.
випливає, що
середнє
значення кінетичної енергії поступального
руху молекул не залежить від природи
газу, а визначається тільки його
температурою.
отримаємо
ще
один вираз
основного
рівняння МКТ
![]() який показує
взаємозв’язок тиску газу з температурою.
який показує
взаємозв’язок тиску газу з температурою.
43.
Із рівняння
![]() зробимо висновок про те, що абсолютна
температура є еквівалентом середньої
квадратичної швидкості молекул газу.
зробимо висновок про те, що абсолютна
температура є еквівалентом середньої
квадратичної швидкості молекул газу.
Блок – схема до розв’язування задач



V=a·b·c V=4/3·π·R3 V=π·R2·h
![]()
![]()

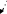


 m0
=M/NA=m/N
m0
=M/NA=m/N
![]()
![]() дивись
табл. густин
дивись
табл. густин
За Н.У. →VМ=22,4·10-3м3
П.С.Х.Е –Д.І. Мендєлєєва NА=6,02 ·1023моль-1
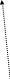


![]()

![]()
![]() Т
=
273 + t.
Т
=
273 + t.



![]()
![]()
![]()

![]()
Розв’язування задач.
1. Скільки молекул знаходиться в 1 г вуглекислого газу? Молярна маса вуглекислого газу - 44 г/моль. а) 2*Ю22; б) 2,5*1О22; в) 1,37*1022; г) 1022; д) вірної відповіді тут немає.
2. Яка маса однієї молекули вуглекислого газу СО2? Молярна маса вуглекислого газу 44 г/моль. а)2*10ˉ26кг; б)2,5*10ˉ26кг; в) 10ˉ26кг; г)7,3810ˉ2бкг; д) вірної відповіді тут немає.
3. Який об’єм займають чотири моль алюмінію? Молярна маса 27 г/моль, густина алюмінію 2700 кг/м³.
а) 40 см³; б) 3 см³; в) 2 мм³; г) 3 мм³; д) вірної відповіді тут немає.
4. Яка середня квадратична швидкість молекул водню під тиском 100 кПа і при концентрації молекул 10² мˉ³? Молярна маса водню 2 г/моль. а) 1,5 км/с; б) 2 км/с; в) 3 км/с; г) 3,5 км/с.
5. Яка середня квадратична швидкість руху молекул водню при температурі 27°С? Молярна маса водню 2 г/моль. а) 700 м/с; б) 1200 м/с; в) 1934 м/с; г) 980 м/с.
