
- •Российский государственный университет нефти и газа им. И.М. Губкина
- •Содержание
- •II стадия синтеза 20
- •Уравнение основной и побочной реакции 20
- •2. Теоретическая часть
- •2.1 Формула соединения и его названия
- •2.2 Физические свойства соединения
- •2.3 Химические свойства диазосоединений
- •2.3.1 Механизм реакции диазотирования.
- •2.3.2 Кислотно-основные свойства диазосоединений.
- •2.3.3 Реакции диазосоединений
- •2.3.4 Химические свойства получаемого соединения
- •2.4 Методы получения соединения
- •3. Экспериментальная часть
- •3.1 I стадия синтеза
- •3.11 Уравнение основной реакции:
- •3.1.2 Характеристики и расчёт количеств исходных реагентов:
- •3.1.3 Описание синтеза, константы полученного соединения,
- •3.2 II стадия синтеза
- •3.2.1 Уравнение основной реакции:
- •3.2.2 Характеристики и расчёт количеств исходных реагентов:
- •3.2.3 Описание синтеза, константы полученного соединения,
- •Воронкой.
- •С водяным паром:
- •Делительная воронка
- •3.2.4 Техника безопасности
- •4. Вывод
- •5. Использованная литература
3.1.3 Описание синтеза, константы полученного соединения,
выход его, в % от теоретического
Реактивы: нитробензол (ρ =1,2) 13,25 г; чугунные стружки 13,5 г; 3%-ная соляная кислота (HCl) 16,15 мл; гидроксид натрия (NaOH) 4,31 г; хлорид натрия (HCl) 16,16 г; диэтиловый эфир (C2H5)2O 21,54 мл.
Посуда и оборудование: круглодонная колба вместимостью 500 мл; водяной холодильник; колбы конические вместимостью 250, 100 и 50 мл; делительная воронка вместимостью 250 мл; установка для простой перегонки, укомплектованная колбой Вюрца вместимостью 50 мл, водяным и воздушным холодильником; парообразователь.
В круглодонную колбу вливают 16,15 мл. 3%-ной соляной кислоты, 13,25 г. нитробензола, а затем добавляют 13,25 г. чугунных стружек. Колбу соединяют обратным холодильником и реакционную массу осторожно доводят до кипения и кипятят 4 ч. До исчезновения запаха нитробензола. По окончании восстановления колбу охлаждают до 40 – 500С, прибавляют 2 г. едкого натра до щелочной реакции на фенолфталеин, колбу закрывают резиновой пробкой, снабженной пароподводящей и изогнутой трубками, подсоединяют парообразователь, прямой водяной холодильник и отгоняют анилин с водяным паром (примерно 100- 120 мл. дистиллята). В дистилляте растворяют 20 г. хлорида натрия, отделяют маслянистый слой анилина, а из водного слоя извлекают остатки анилина эфиром ( два раза по 20 мл.) эфирные вытяжки смешивают с анилином, добавляют 6 г. гидроксида натрия и оставляют на 12-18 часов.
В колбу Вюрца заливают 35 мл. высушенного
эфирного раствора анилина, и используя
водяной холодильник, на водяной бане
отгоняют эфир.
В колбу добавляют остатки эфирного
раствора, завершают отгонку эфира,
заменяют водяную баню песчаной, а водяной
холодильник воздушным. Перегоняют
(очищают от нелетучих или трудно летучих
примесей) анилин с помощью газовой
горелки на воронке Бабо, с добавлением
цинка. При этом перегонную колбу нужно
заполнять не больше чем на 2/3, с добавлением
«кипелок». Отогнать фракцию при 180 –
1840С.
колбу Вюрца заливают 35 мл. высушенного
эфирного раствора анилина, и используя
водяной холодильник, на водяной бане
отгоняют эфир.
В колбу добавляют остатки эфирного
раствора, завершают отгонку эфира,
заменяют водяную баню песчаной, а водяной
холодильник воздушным. Перегоняют
(очищают от нелетучих или трудно летучих
примесей) анилин с помощью газовой
горелки на воронке Бабо, с добавлением
цинка. При этом перегонную колбу нужно
заполнять не больше чем на 2/3, с добавлением
«кипелок». Отогнать фракцию при 180 –
1840С.
3.2 II стадия синтеза
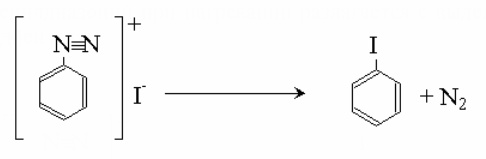
3.2.1 Уравнение основной реакции:


Йодистый фенилдиазоний при нагревании разлагается с выделением азота и образованием йодбензола:
Уравнение побочной реакции:
В качестве побочного продукта реакции получается фенол согласно уравнению:

Присутствие избытка йодистого калия препятствует протеканию побочной реакции.
3.2.2 Характеристики и расчёт количеств исходных реагентов:
Расчёт по уравнению реакции (или расчёт теоретических количеств реагентов, необходимых для получения 5г. йодбензола).
Для синтеза 1г\моль йодбензола (С6Н5I) необходимо 1г\моль анилина (С6Н5NH2);
204,01 г. С6Н5I — 93,07 г. С6Н5NH2
5,0 г. С6Н5I — х г. С6Н5NH2
х =
![]() г. или
≈ 0,02 г\моль
(С6Н5NH2);
г. или
≈ 0,02 г\моль
(С6Н5NH2);
Для синтеза 1г\моль йодбензола (С6Н5I) необходимо 1г\моль нитрита натрия (NaNO2);
204,01 г. С6Н5I — 69,00 г. NaNO2
5,0 г. С6Н5I — х г. NaNO2
х =
![]() г. или
≈ 0,02 г\моль
(NaNO2);
г. или
≈ 0,02 г\моль
(NaNO2);
Для синтеза 1г\моль йодбензола (С6Н5I) необходимо 1г\моль серной кислоты (H2SO4);
204,01 г. С6Н5I — 98,06 г. H2SO4
5,0 г. С6Н5I — х г. H2SO4
х =
![]() г. или
≈ 0,02 г\моль
(H2SO4);
г. или
≈ 0,02 г\моль
(H2SO4);
Для синтеза 1г\моль йодбензола (С6Н5I) необходимо 1г\моль йодида калия (KI);
204,01 г. С6Н5I — 166,0г. KI
5,0 г. С6Н5I — х г. KI
х =
![]() г. или
≈ 0,02 г\моль
(KI);
г. или
≈ 0,02 г\моль
(KI);
Перерасчёт количеств веществ по методике.
В практикуме С.С. Гитиса для получения 21,5г. йодбензола (С6Н5I) используется свежеперегнанный анилин—10г. (9,9мл.); серная кислота (р=1,9203г/см3)—20,2г.; нитрит натрия — 7,7г; иодид калия — 29г.; гидроксид натрия, 10%-ный раствор— 32мл.; хлорид кальция (безводный); мочевина сухая.
Для синтеза 21,5 г. йодбензола (С6Н5I) берётся 10 г. (9,9 мл) анилина (С6Н5NH2);
5 г. йодбензола (С6Н5I) — х г. анилина (С6Н5NH2)
х =
![]() г. или
≈ 0,025 г\моль
(С6Н5NH2);
г. или
≈ 0,025 г\моль
(С6Н5NH2);
Для синтеза 21,5 г. йодбензола (С6Н5I) берётся 7,7 г. нитрита натрия (NaNO2);
5 г. йодбензола (С6Н5I) — х г. нитрита натрия (NaNO2)
х =
![]() г. или
≈ 0,026 г\моль
(NaNO2);
г. или
≈ 0,026 г\моль
(NaNO2);
Для синтеза 21,5 г. йодбензола (С6Н5I) берётся 20,2 г. серной кислоты (H2SO4);
5 г. йодбензола (С6Н5I) — х г. серной кислоты (H2SO4)
х =
![]() г. или
≈ 0,048 г\моль
(H2SO4);
г. или
≈ 0,048 г\моль
(H2SO4);
Для синтеза 21,5 г. йодбензола (С6Н5I) берётся 29 г. йодида калия (KI);
5 г. йодбензола (С6Н5I) — х г. йодида калия (KI)
х =
![]() г. или
≈ 0,041 г\моль
(KI);
г. или
≈ 0,041 г\моль
(KI);
полученные расчетные данные заносим в таблицу
Таблица – 2 «Характеристики и количества исходных реагентов
и продукта реакции»
Название реактивов |
Брутто-формула |
Мол. масса |
Основные константы |
Количества исходных реагентов |
|||||||
Ткип., 0С |
Тпл., 0С |
d420, г\см3 |
по реакции |
по методике |
изб. |
||||||
г |
г\моль |
г |
мл |
г\моль |
г\моль |
||||||
анилин |
С6Н5NH2 |
93,07 |
184,4 |
-5,89 |
1,0217 |
2,28 |
0,02 |
2,33 |
2,28 |
0,025 |
|
нитрит натрия |
NaNO2 |
69,00 |
- |
271,0 |
2,17 |
1,69 |
0,02 |
1,79 |
0,82 |
0,026 |
|
серная кислота |
H2SO4 |
98,06 |
296,2 |
10,3 |
1,9203 |
2,4 |
0,02 |
4,7 |
2,45 |
0,048 |
|
иодид калия |
KI |
166,0 |
1324,0 |
686,0 |
— |
4,07 |
0,02 |
6,74 |
8,14 |
0,041 |
|
[2, с.571]
