
- •Российский государственный университет нефти и газа им. И.М. Губкина
- •Содержание
- •II стадия синтеза 20
- •Уравнение основной и побочной реакции 20
- •2. Теоретическая часть
- •2.1 Формула соединения и его названия
- •2.2 Физические свойства соединения
- •2.3 Химические свойства диазосоединений
- •2.3.1 Механизм реакции диазотирования.
- •2.3.2 Кислотно-основные свойства диазосоединений.
- •2.3.3 Реакции диазосоединений
- •2.3.4 Химические свойства получаемого соединения
- •2.4 Методы получения соединения
- •3. Экспериментальная часть
- •3.1 I стадия синтеза
- •3.11 Уравнение основной реакции:
- •3.1.2 Характеристики и расчёт количеств исходных реагентов:
- •3.1.3 Описание синтеза, константы полученного соединения,
- •3.2 II стадия синтеза
- •3.2.1 Уравнение основной реакции:
- •3.2.2 Характеристики и расчёт количеств исходных реагентов:
- •3.2.3 Описание синтеза, константы полученного соединения,
- •Воронкой.
- •С водяным паром:
- •Делительная воронка
- •3.2.4 Техника безопасности
- •4. Вывод
- •5. Использованная литература
2.3.4 Химические свойства получаемого соединения
В отличие от галогеналкилов простые галогенарилы – весьма нереакционные вещества по отношению к нуклеофильным реагентам. Они не реагируют с едким натром, солями серебра, цианидом, сульфидом и алкоголятами натрия или с аммиаком в тех условиях, в которых протекает реакция замещения с участием галогеналкилов.
Для йодбензола, как и для всех галогенобензолов, характерны реакции электрофильного замещения водородов ядра преимущественно в пара- и орто- положения; при этом пассивирующее влияние атома йода в реакциях замещения проявляется в меньшей степени, чем в случае хлора и брома.
В некоторых случаях при введении заместителей в ядро подвижность йода может резко возрасти. Это происходит, если в орто- или пара- положениях по отношению к йоду находятся электроноакцепторная группа, особенно NO2, а также СООН, CN, SO3H. лёгкость обычного нуклеофильного замещения галогена в этом случае обусловлена тем, что заместитель второго рода в орто- или пара-положении стабилизирует промежуточный σ-комплкс путём частичного перераспределения отрицательного заряда.
Атомы водорода в ядре ароматических галогенпроизводных способны замещаться галогенами, нитрогруппой, сульфогруппой и т.д. Так, при нитровании йодбензола азотной кислотой образуется смесь, содержащая 59% n-нитройодбензола и 41% о-изомера; относительные скорости нитрования бензола, йодбензола, бром- и хлорбензолов составляют:
1 : 0,18 : 0,030 : 0,033. При сульфировании образуются:
n-йодбензолсульфокислота, n-дийодбензол и бензолсульфокислота (при использовании серной кислоты), бис-n-йодфенилсульфон (при использовании олеума или хлорсульфоновой кислоты). При галогенировании образуются n- и о-йодгалогенобензолы и 3,5-дигалогенйодбензол.
Йодбензол, как и другие йодароматические соединения, характеризуются лёгкой окисляемостью с образованием неустойчивых продуктов (Галогенониевых соединений). Так при действии на йодбензол перекиси водорода из надсерной кислоты образуется йодозобензол, при действии озона или органических перекисей – йодобензол, при действии хлора в безводной среде – фенилйододихлорид:

С металлами йодбензол даёт органические соединения почти с такой же лёгкостью, как и галогенпроизводные жирного ряда:
С6Н5I + Mg → C6H5MgI
Благодаря этой особенности галоген в ядре может быть замещён различными группировками, например карбоксильной группой.
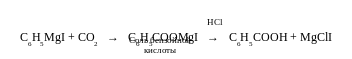
Ароматические йодпроизводные способны давать соединения с расширением октета до децета и более у атома йода. Так, например возможен следующий цикл превращений:

Йодбензол используют как промежуточный препарат в органическом синтезе, в частности для синтеза этилбензола и бензойной кислоты.
Дийодбензол С6Н4I2 , молекулярный вес 329,93 существует в трёх изомерных формах. Все изомеры трудно растворимы в воде, растворимы в спирте, эфире.
Таблица 1 - Свойства изомеров дийодбензола
Изомер |
орто (1,2) |
мета (1,3) |
пара (1,4) |
Тпл., 0С |
27 |
40 |
129,4 |
Ткип., 0С |
286-287 |
285 |
285 |
Теплота плавления, кал/г |
10,2 |
11,55 |
16,21 |
Диэлектрическая проницаемость, ε |
1,27 |
1,69 |
0 |
о- и м- Дийодбензолы получают из соответствующих диазотированных иоданилинов разложением их НJ; n-дийодбензол образуется вместе с йодбензолом при кипячении бензола с йодом и персульфатом натрия в уксусной кислоте. Дийодбензолы ограниченно применяют в органическом синтезе.
Полийодбензолы – бесцветные или слегка жёлтые с эфирным запахом; хорошо растворяются в большинстве органических растворителей.
[3, с.290]
