
- •3) Закон кратных отношений (Джон Дальтон, 1803 г.): :
- •Эквиваленты.
- •4. Газовые законы и их характеристика
- •6. Закон Авогадро: (Авогадро, 1811г.) – в равных объемах различных газов при одинаковых условиях (температуры и давлении) содержится одинаковое число молекул.
- •6. Квантовые числа и их характеристика
- •7. Периодический закон и периодическая система элементов д.И.Менделеева.
- •8. Энергия ионизации и сродство к электрону
- •9. Положения Бутлерова:
- •11. Ионная связь осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов.
- •14. Катализ
- •1 ) Изоляция металла от коррозийной среды.
- •3) Ингибиторы коррозии
7. Периодический закон и периодическая система элементов д.И.Менделеева.
ПЗ- свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов(современная ф)
свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
В периодах отначала к периода к концу (слева направо) усиливаются кислотные (неметаллические) свойства и ослабевают основные (металлические) свойства в связи с увеличением количества электронов на внешнем электронном уровне. В группах от начала к концу (сверху вниз) усиливаются металлические (основные) свойства и ослабевают неметаллические (кислотные свойства) в связи с увеличением электронных уровней и меньшим притяжение электронов внешнего уровня к ядру.Данные о строении ядра и о распределении электронов в атомах позволяют рассмотреть периодический закон и периодическую систему элементов с фундаментальных физических позиций. На базе современных представлений периодический закон формулируется так:Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера).
Различают 2 основных вида Периодических таблиц:
1) Короткопериодная таблица (8групп);
2) длиннопериодная таблица (32 группы)
8. Энергия ионизации и сродство к электрону
Энергией ионизации I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома:

Энергия ионизации выражается в Кдж/моль или эВ/атом.
Сродством к электрону называется энергетический эффект F процесса присоединения электрона к нейтральному атому Э с превращением его в отрицательный ион Э–
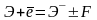
Сродство к электрону может быть выражено в Кдж/моль или эВ/атом.
Сродство к электрону численно равно, но противоположно по знаку энергии ионизации отрицательно заряженного иона Э–.
Электроотрицательность атома, величина, характеризующая способность атома в молекуле притягивать электроны, участвующие в образовании химической связи.
Мерой электроотрицательности может служить арифметическая сумма энергии ионизации I и сродства к электрону F
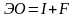
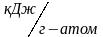
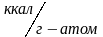
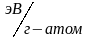
Согласно одному из определений (Мелликен) электроотрицательность атома может быть выражена как полусумма его энергии ионизации и сродства к электрону:
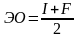
по периоду слева направо
заряд ядра и суммарный заряд электронов увеличиваются
– сила притяжения между ядром и электронами возрастает;
2) число энергетических уровней остается постоянным;
3) у элементов больших периодов заполняется d-подуровень
(а начиная с 6 периода и f-подуровень) – действует эффект
d- и f-сжатия.
В конечном итоге: сила притяжения между ядром и
электронами возрастает, радиус атома уменьшается,
потенциал ионизации увеличивается, восстановительная
активность снижается, усиливаются окислительные
свойства и электроотрицательность.
(по группам сверху вниз)(-s,-p):
1) заряд ядра и суммарный заряд электронов возрастают;
2) число энергетических уровней увеличивается,
электроны удаляются от ядра, и сила притяжения уменьшается;
3) d- и f-сжатие действует слабо, так как эти электроны
остаются во внутренних оболочках.
Таким образом по группе сверху вниз: радиус атома
увеличивается; потенциал ионизации уменьшается,
восстановительная активность возрастает, а окислительные свойства и электроотрицательность уменьшаются.
d-элементов по группе сверху вниз (правая часть d-семейства):
1) заряд ядра и суммарный заряд электронов возрастают;
2) число энергетических уровней увеличивается, но
незначительно;
3) очень сильно действует эффект d и f-cжатия, так как d- и f- подуровни все более близки к заполнению.
В результате – радиус атома уменьшается, потенциал
ионизации возрастает, восстановительная активность
уменьшается, электроотрицательность также уменьшается.
