
- •3) Закон кратных отношений (Джон Дальтон, 1803 г.): :
- •Эквиваленты.
- •4. Газовые законы и их характеристика
- •6. Закон Авогадро: (Авогадро, 1811г.) – в равных объемах различных газов при одинаковых условиях (температуры и давлении) содержится одинаковое число молекул.
- •6. Квантовые числа и их характеристика
- •7. Периодический закон и периодическая система элементов д.И.Менделеева.
- •8. Энергия ионизации и сродство к электрону
- •9. Положения Бутлерова:
- •11. Ионная связь осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов.
- •14. Катализ
- •1 ) Изоляция металла от коррозийной среды.
- •3) Ингибиторы коррозии
Молекулярная,атомнаямасса. Стехиометрические законы химии.
Атомная масса – это масса химического элемента, выраженная в атомных единицах массы (а. е.м.). За 1 а. е.м. принята 1/12 часть массы изотопа углерода с атомным весом 12. 1а.е.м.=1,6605655·10-27 кг. Атомная масса складывается из масс всех протонов и нейтронов в данном атоме.
Mr – относительная молекулярная масса – частное от деления массы молекулы соединения на 1/12 абсолютной массы атома изотопа углерода-12, равна сумме относительных атомных масс всех атомов, составляющих молекулу соединения.
1) Закон сохранения массы веществ: (М.В.Ломоносов, 1748г): масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
2) Закон постоянства состава: (Пруст, 1808г) – всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав. Например: Na2SO4
3) Закон кратных отношений (Джон Дальтон, 1803 г.): :
Если два элемента образуют друг с другом несколько соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся как небольшие целые числа.
4) Закон простых объемных отношений, или «химический» закон (Гей-Люссак, 1808) – объемы вступающих в реакцию газов при одинаковых условиях относятся друг к другу, а также к объемам образующихся газообразных продуктов как небольшие целые числа. Эти числа совпадают со стехиометрическими числами в уравнении реакции. Например:
2Н2 + О2 = 2Н2О.
6. Закон Авогадро: (Авогадро, 1811г.) – в равных объемах различных газов при одинаковых условиях (температуры и давлении) содержится одинаковое число молекул.
Эквиваленты.
Химическим эквивалентом элемента называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Химический эквивалент не является постоянной величиной, он зависит от валентности элемента
5) Закон эквивалентов: (В. Рихтер, 1793 г.) – вещества взаимодействуют между собой в количествах, пропорциональных их химическим эквивалентам.
Значение эквивалентной массы элемента определяется по уравнению:
Э=А/В, (1) где
Э - эквивалентная масса элемента;
А - атомная масса элемента;
В - валентность элемента в данном соединении.
Например, ЭAl в Аl2О3 равен 27/3=9 г/моль; ЭCa в СаSO4 равен 40,08/2=20,04 г /моль.
Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества.
Эквивалентную массу вещества вычисляют из его молярной массы:
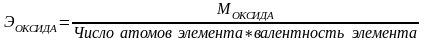
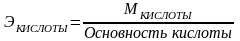

, где
М - молярная масса.
Основность кислоты определяется числом атомов водорода, которое отдаёт молекула кислоты, реагируя с основанием.
Кислотность основания определяется числом протонов, присоединённых молекулой основания при взаимодействии его с кислотой.
Подобно эквивалентной массе элемента, эквивалентная масса сложного вещества может иметь несколько значений в зависимости от реакции, в которой участвуют вещества.
Например, в реакции:
H3PO4 + NaOH NaH2PO4 + H2O.
Эквивалентная масса кислоты равна её мольной массе:
Э(H3PO4) = М / 1 = 98 г / моль.
В реакции
H3PO4 + 2NaОН Na2HPO4 + 2H2O
Э(H3PO4) = М / 2 = 49 г / моль.
В реакции
H3PO4 + 3NaОН Nа3РO4 + ЗН2О
Э(H3PO4) = M / 3 = 32.7 г / моль.
Эквивалентный объем водорода при н.у. равен 11,2 л(кислорода – 5.6)
3.
4. Газовые законы и их характеристика
З акон
Бойля–Мариотта:
при постоянной температурe,
давление, производимое данной массой
газа, обратно пропорционально объему
газа
акон
Бойля–Мариотта:
при постоянной температурe,
давление, производимое данной массой
газа, обратно пропорционально объему
газа
Закон Гей-Люссака: при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре

Закон Шарля: при постоянном объеме давление газа изменяется прямо пропорционально абсолютной температуре.

О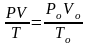 бъединенный
закон Бойля-Мариотта, Гей-Люссака и
Шарля:
бъединенный
закон Бойля-Мариотта, Гей-Люссака и
Шарля:
Уравнение Клапейрона-Менделеева:

Закон парциальных давлений Дальтона:
Общее давление газовой смеси равно сумме парциальных давлений газов, составляющих эту смесь: n
Р(общ)=Σ(Рi)
i=1
