
- •Осмос, осмотическое давление. Биологическое значение осмоса. Понятие об изотонических, гипертонических и гипотонических растворах.
- •Буферные растворы и буферная емкость. Буферные системы живого организма и их значение.
- •Аминокислотный состав белков.
- •Превращение аминокислот в тканях.
- •Классификация аминокислот, их строение и номенклатура. Образование пептидной связи. Качественные реакции аминокислот .
- •10. Переваривание белков в пищеварительном тракте.
- •11. Характеристика сложных белков. Нахождение и роль в организме животных.
- •13. Конечный обмен белков. Орнитиновый цикл.
- •14. Ферменты их роль в организме. Механизм и условия действия ферментов
- •19. Нуклеопротеиды. Обмен нуклеиновых кислот.
- •20. Состав и структура рнк. Виды рнк и их функции
- •21. Биосинтез белка. Стадии биосинтеза белка.
- •24. Цикл трикарбоновых кислот и синтез атф.
- •25. Тканевое дыхание. Дыхательная цепь.
- •27. Ферменты углеводного обмена, их характеристика.
- •28. Липиды и их классификация. Структура липидов, их свойства и функции.
- •29. Обмен жиров. Превращение жиров в пищеварительном тракте.
- •30. Промежуточный обмен липидов.
14. Ферменты их роль в организме. Механизм и условия действия ферментов
Фермент-это биокатализаторы белковой природы, которые в значительной мере ускоряют ход биохимических реакций путем снижения энергии активации реагирующих веществ при умеренной температуре и физиологических значениях рН; сами ферменты при этом не расходуются. Вещества, с которыми взаимодействует фермент в процессе катализа, называются субстратами.
Механизм ферментативного катализа реализуется в 2 этапа : образование фермент-субстратного комплекса ES и образования продукта Р. Образование комплекса ES проходит через стадии образования комплексов ES1 и ES2. Схематически это можно выразить следующим образом :
E+S <-> ES1<->ES2<->E+P
Образование комплекса ES1 носит обратимый характер, т.е. ES1 может либо распадаться до свободного фермента и субстрата, либо превратиться в ES2 .В свою очередь, комплекс ES2 может либо распадаться с образованием продукта и свободного фермента, либо превратиться в комплекс ES1, а затем в свободный фермент Е и субстрат S. В зависимости от констант скоростей этих реакций фермент-субстратный комплекс будет либо быстро распадаться на субстрат и фермент, либо распадаться с образованием продукта Р и свободного фермента.
Скорость ферментативных реакций зависит от химической природы реагируемых веществ, температуры, количества фермента Е, субстрата S, и рН среды .Оптимальный для ферментов температурой считается 37, нормальное атмосферное давление и показатель рН, близкий к нейтральному. С повышением температуры и давления активность многих ферментов повышается. Максимальный считается температура 45,выше которой активность резко снижается, т.к. при таких температурах структура ферментов начинает быстро разрушаться.
Ферменты усложняют реакцию, проводя ее по более сложному пути, не требующему энергетических затрат. 15. Классификация ферментов по типу химических реакций.
1)оксидоредуктазы, катализирующие окислительно-восстановительные реакции;
2)трансферазы, осуществляющие перенос групп атомов, отличных от атомов водорода;
3)гидролазы, расщипляющие связи с участием молекул воды;
4)лиазы, обеспечивающие образование двойных связей за счет удаления или добавления групп атомов;
5)изомеразы, осуществляющие внутримолекулярный перенос групп атомов и образования изомерных форм;
6)лигазы, соединяющие две молекулы с образованием связей C-C ,C-O, C-S,C-N за счёт энергии разрыва форсофороэфирных связей АТР. 16. Общие свойства ферментов: каталитическая способность, условия максимального проявления каталитического действия. Применение ферментов.
1)смотри вопрос 14
2)применение ферментов
Ферменты нашли широкое применение в таких отраслях промышленности, как хлебопечение, пивоварение, виноделие, чайное, кожевенное и меховое производства, сыроварение, кулинария (для обработки мяса) и т.д. В последние годы ферменты стали применять в тонкой химической индустрии для осуществления таких реакций органической химии, как окисление, восстановление, дезаминирование, декарбоксилирование, дегидратация,конденсация, а также для разделения и выделения изомеров аминокислот L-ряда (при химическом синтезе образуются рацемические смеси L- и D-изомеров), которые используют в промышленности, сельском хозяйстве, медицине. Овладение тонкими механизмами действия ферментов, несомненно, предоставит неограниченные возможности получения в огромных количествах и с большой скоростью полезных веществ в лабораторных условиях почти со 100% выходом. 17. Ферменты белкового обмена. Условия проявления наибольшей активности ферментов.
1)хрень какая то вылезает,в учебнике тоже нету
2)см. вопрос 14
сам не знаю=) я тоже ленивый=) 18. Нуклеиновые кислоты их состав. Структура ДНК. Принцип комплементарности
нуклеиновые кислоты — биополимеры, а их функция заключается в хранении, реализации и передаче генетической (наследственной) информации в живых организмах.
Существует два типа нуклеиновых кислот — дезоксирибонуклеиновые (ДНК) и рибонуклеиновые (РНК). Мономерами в нуклеиновых кислотах служат нуклеотиды. Каждый из них содержит азотистое основание, пятиуглеродный сахар (дезоксирибоза — в ДНК, рибоза — в РНК) и остаток фосфорной кислоты.
В ДНК входят четыре вида нуклеотидов, отличающихся по азотистому основанию в их составе, — аденин (А), гуанин (Г), цитозин (Ц) и тимин (Т). В молекуле РНК также имеется 4 вида нуклеотидов с одним из азотистых оснований — аденином, гуанином, цитозином и урацилом (У). Таким образом, ДНК и РНК различаются как по содержанию сахара в нуклеотидах, так и по одному из азотистых оснований (табл. 1).
Таблица 1
Компоненты нуклеотидов ДНК и РНК
Нуклеиновая кислота |
Пятиуглеродный сахар |
Азотистые основания |
Остаток фосфорной кислоты |
ДНК |
Дезоксирибоза |
Аденин, гуанин, цитозин, тимин |
Остаток фосфорной кислоты |
РНК |
Рибоза |
Аденин, гуанин, цитозин, урацил |
Остаток фосфорной кислоты |
Молекулы ДНК и РНК существенно различаются по своему строению и выполняемым функциям.
Молекула ДНК может включать огромное количество нуклеотидов — от нескольких тысяч до сотен миллионов (поистине гигантские молекулы ДНК удается «увидеть» с помощью электронного микроскопа). В структурном отношении она представляет собой двойную спираль из полинуклеотидных цепей (рис. 1), соединенных с помощью водородных связей между азотистыми основаниями нуклеотидов. Благодаря этому полинуклеотидные цепи прочно удерживаются одна возле другой.
При исследовании различных ДНК (у разных видов организмов) было установлено, что аденин одной цепи может связываться лишь с тимином, а гуанин — только с цитозином другой. Следовательно, порядок расположения нуклеотидов в одной цепи строго соответствует порядку их расположения в другой. Этот феномен получил название комплементарности (т. е. дополнения), а противоположные полинуклеотидные цепи называютсякомплементарными. Именно этим обусловлено уникальное среди всех неорганических и органических веществ свойство ДНК — способность к самовоспроизведению или удвоению (рис. 2). При этом сначала комплементарные цепи молекул ДНК расходятся (под воздействием специального фермента происходит разрушение связей между комплементарными нуклеотидами двух цепей). Затем на каждой цепи начинается синтез новой («недостающей») комплементарной ей цепи за счет свободных нуклеотидов, всегда имеющихся в большом количестве в клетке. В результате вместо одной («материнской») молекулы ДНК образуются две («дочерние») новые, идентичные по структуре и составу друг другу, а также исходной молекуле ДНК. Этот процесс всегда предшествует клеточному делению и обеспечивает передачу наследственной информации от материнской клетки дочерним и всем последующим поколениям.
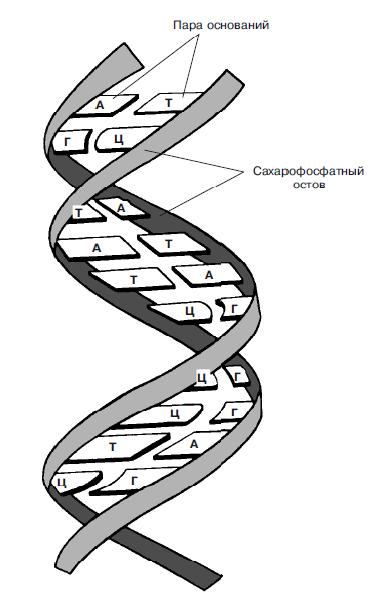
Рис. 1. Двойная спираль ДНК. Две цепи обвиты одна вокруг другой. Каждая цепь (изображенная в виде ленты) состоит из чередующихся остатков сахара и фосфатных групп. Водородные связи между азотистыми основаниями (А, Т, Г и Ц) удерживают две цепи вместе
(оставил для наглядности, а так... «сжечь свитер на фиг!», то есть можно удалять картинки=))
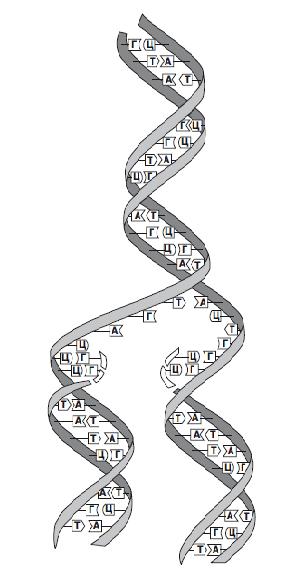
Рис. 2. Репликация ДНК. Двойная спираль «расстегивается» по слабым водородным связям, соединяющим комплементарные основания двух цепей. Каждая из старых цепей служит матрицей для образования новой: нуклеотиды с комплементарными основаниями выстраиваются против старой цепи и соединяются друг с другом
Молекулы РНК, как правило, одноцепочечные (в отличие от ДНК) и содержат значительно меньшее число нуклеотидов. Выделяют три вида РНК (табл. 2), различающиеся по величине молекул и выполняемым функциям, — информационную (иРНК), рибосомальную (рРНК) и транспортную (тРНК).
Таблица 2
Три вида РНК
РНК |
Число нуклеотидов в молекуле |
Информационные |
До 30 000 |
Рибосомальные |
До 6000 |
Транспортные |
Около 100 |
Информационная РНК (и-РНК) располагается в ядре и цитоплазме клетки, имеет самую длинную полинуклеотидную цепь среди РНК и выполняет функцию переноса наследственной информации из ядра в цитоплазму клетки.
Транспортная РНК (т-РНК) также содержится в ядре и цитоплазме клет-ки, ее цепь имеет наиболее сложную структуру, а также является самой короткой (75 нуклеотидов). Т-РНК доставляет аминокислоты к рибосомам в процессе трансляции — биосинтеза белка.
Рибосомальная РНК (р-РНК) содержится в ядрышке и рибосомах клетки, имеет цепь средней длины. Все виды РНК образуются в процессе транскрипции соответствующих генов ДНК.
Больше всего (где — то 80%) РНК приходится на Рибосомную, потом идет Транспортная и Матричная
