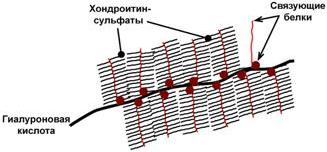
Протеогликаны
Другая группа гликоконъюгатов – протеогликаны – характеризуется наличием крупных полисахаридов, состоящих из повторяющихся дисахаридных остатков.
Дисахариды включают в себя какую-либо уроновую кислоту и аминосахар. Многократно дублируясь, дисахариды образуют олиго- и полисахаридные цепи – гликаны. Для углеводной части встречаются другие названия – кислые гетерополисахариды (т.к. имеют много кислотных групп), гликозаминогликаны (содержат аминогруппы). Основными представителями гликозаминогликанов являются гиалуроновая кислота, хондроитинсульфаты, кератансульфаты и дерматансульфаты, гепарин. Эти молекулы входят в состав протеогликанов, функцией которых является заполнение межклеточного пространства и удержание здесь воды, также они выступают как смазочный и структурный компонент суставов и других тканевых структур.
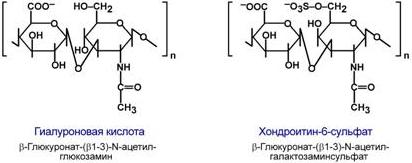
Строение гиалуроновой кислоты и хондроитинсульфата
Углеводная часть, аналогично с гликопротеинами, связывается с белком через остатки серина и аспарагина.
Схема строения протеогликанов межклеточного вещества |
1.3.Стероидные гормоны.
Стероидные гормоны - один из главных классов гормональных соединений всех видов позвоночных и многих видов беспозвоночных животных. Они являются регуляторами фундаментальных процессов жизнедеятельности многоклеточного организма - координированного роста , дифференцировки , размножения , адаптации , поведения [ Хартман Э., 1972 ].
Действие стероидных гормонов на клетки-мишени осуществляется, главным образом, на уровне регуляции транскрипции генов . Оно опосредуется образованием комплекса гормона со специфическим регуляторным белком - рецептором , узнающим определенные участки ДНК в генах, регулируемых данным гормоном. Таким образом, рецепторы всех стероидных гормонов - лиганд-зависимые факторы транскрипции. Для них характерно значительное сходство аминокислотных последовательностей, идентичная доменная структура и сходный механизм действия. Вместе с близкими им рецепторами тиреоидных гормонов они объединяются в семейство рецепторов стероидных/тиреоидных гормонов , которое входит в более обширное надсемейство регуляторных белков - ядерных рецепторов [ Mangelsford D.J. et al., 1995 ].
Стероидные гормоны синтезируются из холестерина , в основном, в коре надпочечников , тестикулах , яичниках и плаценте ; однако, каждая ткань, продуцирующая стероиды, имеет свой собственный характерный профиль продуктов секреции.
Подобно надпочечникам, половые железы продуцируют довольно много стероидов, но лишь некоторые из них обладают гормональной активностью. Образование этих гормонов строго регулируется с помощью петли обратной связи , включающей в себя гипофиз и гипоталамус . Действие половых гормонов опосредовано ядерными механизмами, подобными тем, которые используются кортикостероидами .
Стероидные соединения плохо растворяются в воде и хорошо в органических растворителях и растительных маслах. Все стероидные гормоны благодаря липофильности относительно легко проникают через плазматические липопротеидные мембраны и поэтому могут свободно секретироваться клетками стероидогенных эндокринных желез и входить внутрь реагирующих клеток.
многие общие названия стероидов базируются на структурных характеристиках различных специфических атомов углерода в молекуле стероидов. Например, 17-оксипрогестерон отличается от прогестерона тем, что он содержит гидроксильный радикал у углерода в 17-положении. Кроме того, название многих ферментативных реакций, участвующих в биосинтезе стероидных гормонов, основывается на номенклатуре нумерации углеводов. Реакция 21- гидроксилирования, например, вводит гидроксильную группу в стероидное ядро в 21 положении
стероиды характеризуются трехмерной пространственной конфигурацией, особенности которой оказывают существенное влияние на их биологическую активность.
Гормоны этого класса представляют полициклические соединения липидной природы, в основе структуры которых, как правило, лежит циклопентанпергидрофенантреновое (стерановое) ядро, состоящее из конденсированных между собой трех насыщенных шестичленных (А,В,С) и одного насыщенного пятичленного кольца (D).
Структурно стероиды отличаются друг от друга количеством и расположением функциональных групп, степенью насыщенности углеводных связей, длиной боковой цепи, прикрепленной к стероидному ядру, и другими химическими характеристиками. Структуры некоторых физиологически важных стероидных гормонов представлены на рис.2-3 .
Хотя часто трудно установить определенную взаимосвязь между структурой и активностью, определенные структурные черты, по всей вероятности, являются общими для стероидов со сходной биологической активностью. Например, стероиды с андрогенной или маскулинизирующей активностью, типичным представителем которых является тестостерон , содержат 19 углеродных атомов и не имеют боковой цепи, прикрепленной к стероидному ядру ( рис.2-3 ). Соединения с эстрогенной или феминизирующей активностью, такие как эстрадиол , содержат 18 углеродных атомов и имеют ароматическое кольцо А. Другие физиологически важные стероидные гормоны содержат 21 углеродный атом и включают в себя кортикостероиды и прогестины.
Геометрическая форма стероидной молекулы достаточно стабильна и определяется конформацией колец (циклогексановые кольца имеют конформацию кресла, а циклопентановое - полукресла), характером их соединения (В/С- и С/D-сочленения имеют транс-конфигурацию), а также расположением атомов водорода, радикалов и функциональных групп, присоединенных к стериновому ядру (альфа-или бета-ориентация в пространстве). Следует отметить, что стероиды - оптически активные соединения. Все природные гормоны являются производными D-ряда.
гены индуцируемые под действием низкомолекулярных стероидных и тироидных гормонов , а также таких регуляторов развития и морфогенеза, как витамин D и ретиноевая кислота .
Эта регуляция появляется в процессе эволюции при переходе от одноклеточных к многоклеточным организмам. например у дрожжей нет соответствующих генов, а у нематоды их более 200. Это связано с процессами развития многоклеточных организмов.
Стероидные и тироидные гормоны, витамин D и ретиноевая кислота в силу своей гидрофобности легко проникают в ядро и связываются с рецепторами.
Рецепторы этих гормонов и регуляторов в своей структуре имеют похожий Zn-фингерный домен - C4 домен Последовательность Nys-X2 - Cys -X13 -Cys-X2 -Cys, в которой 4 остатка цистеина способны образовывать комплекс, давая структуру цинкового пальца. Эта укладка способна участвовать в связывании рецептора с ДНК.
В каждой молекуле рецептора стероидных гормонов содержится по два таких домена. В связывании с ДНК участвует комплекс из двух молекул рецептора. Разные структуры глюкокортикоидного и эстрогенового рецепторов позволяют им связывать разные гормоны. Но при этом они очень близки: замещение всего двух определaнных аминокислот в глюкокортикоидном рецепторе меняет его специфичность, превращая в эстрогеновый.
Как же происходит индукция генов под действием стероидных и тироидных гормонов? Лучше всего это изучено для глюкокортикоидного рецептора . Появляясь в окружении клетки, гормон проникает в нее путем простой диффузии. Внутри клетки он связывается с рецептором , и транспортируется в клеточное ядро рис. стероидный гормон проникает в ядро .
Рецепторы связываются со специфическими последовательностями в промоторах или энхансерах. В результате активируется (или репрессируется) экспрессия тех генов, которые должны реагировать в ответ на действие стероидного гормона. Обычно его элемент отклика GRE находится в энхансерах. Это несовершенный палиндром (см Табл 2 svtr ). С ним связывается димер рецептора в комплексе с лигандом. Точнее сказать димеризация лиганд-связанного рецептора происходит при связывании с палиндромной последовательностью GRE [ Karin ea 1998 ]. При связывании происходит активация энхансера.
Класс стероидных гормонов включает семейства производных четырех углеродных стероидов, содержащих различное количество углеродных атомов (С*4n*5): * прегнана (С*421*5), андростана (С*419*5), эстрана (С*418*5) и холестана (С*427*5).
Прегнановые стероидные гормоны *можно рассматривать как производные С*421*стероида прегнана. Это семейство гормонов состоит из двух основных групп: кортикостероидов - гормонов коры надпочечников и прогестинов *- гормонов яичников и плаценты .
Холестерин и биосинтез стероидных гормонов
Холестерин является общим предшественником всех стероидных гормонов . В соответствии с этим, обмен холестерина в тканях, секретирующих стероиды, чрезвычайно важен для регуляции биосинтеза стероидных гормонов . Основные процессы обмена холестерина представлены на рис. 1-5сер .
В течение многих лет считалось, что весь или большая часть холестерина, используемого для стероидогенеза синтезируется из ацетата в клетках, продуцирующих стероиды.
Хотя синтез холестерина действительно имеет место в этих клетках, липопротеины плазмы, которые синтезируются в печени , по всей вероятности, являются главным источником холестерина, используемого для стероидогенеза ( рис.1-4сер ).
Относительная важность различных классов липопротеинов как источников холестерина для стероидогенеза зависит от вида животного, но у человека липопротеины низкой плотности ( ЛПНП ) играют наиболее важную роль.
Мембранные рецепторы липопротеинов обнаружены в стероид-продуцирующих клетках и связывание липопротеина с рецептором приводит к интернализации комплекса липопротеин-рецептор. Попав в стероидогенную клетку, липопротеины разрушаются лизосомальными ферментами и освобождают холестерин; рецептор может подвергаться далее деградации или возвращается в клеточную мембрану для дальнейшего использования. Захват и деградация липопротеинов регулируется гормонами, так что при увеличении потребности в стероидных гормонах, повышенные количества холестерина как субстрата поступают в стероид-продуцирующие клетки.
Свободный холестерин в стероид-продуцирующих клетках, независимо от того, возник ли он из липопротеинов или синтезировался в клетке, может немедленно использоваться для стероидогенеза или превращаться в эфиры холестерина . Клетки, которые синтезируют стероидные гормоны, содержат большое количество эфиров холестерина в структурах, известных как липидные капли . Эфиры холестерина являются основной формой запасов холестеринов и должны подвергнуться гидролизу до свободного холестерина, который используется в стероидогенезе. Скорость гидролиза эфиров холестерина, также как захват и деградация липопротеинов находится под регулирующим воздействием гормонов. Таким образом, доставка свободного холестерина в стероид-продуцирующие клетки может тесно координироваться с общей активностью процессов стероидогенеза.
Стероидогенез
Синтез различных стероидных гормонов из холестерина осуществляется последовательными ферментативными реакциями. Основной путь стероидогенеза , приводящий к образованию минералокортикоидов , глюкокортикоидов , андрогенов и эстрогенов , представлен на рис.1-5сер .
Первая стадия на пути превращения холестерина в прегненолон является реакцией, которая происходит во всех стероид-продуцирующих тканях и считается, что она является стадией, лимитирующей скорость стероидогенеза . В соответствии с этим, регуляция стероидогенеза во всех тканях осуществляется, главным образом, за счет изменения скорости именно этого ферментативного превращения. Реакция удаляет боковую цепь из молекулы холестерина, поэтому она известна как отщепление боковой цепи холестерина. Поскольку фермент, катализирующий отщепление боковой цепи холестерина, локализован, главным образом, во фракции митохондрии, транспорт холестерина из цитозоля в митохондрии клетки необходим для синтеза стероидов. Таким образом регуляция транспорта холестерина играет важную роль в контроле биосинтеза стероидных гормонов.
После образования прегненолона в стероид-продуцирующих клетках, его дальнейшие превращения определяются распределением относительных активностей стероидогенных ферментов внутри клеток. Некоторые ферментативные реакции, указанные на рис.1-5сер , происходят только в определенных тканях, и поэтому продукты этих реакций образуются только в этих тканях. Например, 11-гидроксилирование и 21-гидроксилирование обнаруживается только в коре надпочечников и в результате этого образование глюкокортикоидов и минералокортикоидов ограничивается только этой железой.
Как можно видеть из рис. 1-5сер , многие стадии стероидогенеза являются реакциями гидроксилирования, хотя и другие типы реакций принимают участие в этом процессе. Каждый фермент имеет тенденцию локализоваться в специфических субклеточных образованиях.
Таким образом последовательная модификация стероидной молекулы в ходе стероидогенеза требует ее перемещения от одного субклеточного образования к другому. Внутриклеточная миграция, необходимая для биосинтеза кортизола , например, представлена на рис.1-6сер . Мало известно о механизмах, определяющих внутриклеточное перемещение стероидов, и, в особенности, о механизмах, предотвращающих свободную диффузию промежуточных продуктов биосинтеза из клетки. Постулируется участие в этом транспортных белков, но оно пока не доказано экспериментально. Каким бы не был этот механизм, внутриклеточная миграция, необходимая для биосинтеза гормонов, осуществляется очень эффективно, так что очень мало промежуточных продуктов в нормальных условиях секретируется клеткой. Таким образом, ферментативная модификация стероидного ядра продолжается до тех пор, пока не образуется конечный продукт секреции.
В отличие от пептидных гормонов не существует никакого механизма, способствующего накоплению стероидных гормонов в клетке. Только гормональный предшественник в форме эфиров холестерина накапливается в стероид-продуцирующих клетках в значительных количествах.
Поскольку стероид хорошо растворим в липидной среде, стероидные гормоны после их образования легко диффундируют через липидную клеточную мембрану в кровяное русло.
Таким образом, процессы биосинтеза и секреции стероидных гормонов тесно связаны и скорость их секреции целиком определяется механизмами регуляции скорости биосинтеза гормонов (стероидогенеза).
Лекция 2. Механизм действия гормонов. 2.1.Механизм действия гидрофильных гормонов.
2.1.1.Мембранные рецепторы гормонов
2.1.2. Вторичные посредники гормонов
2.2.Механизм действия гидрофобных гормонов
2.2.1.Внутриклеточные рецепторы стероидных гормонов
Лекция 3. Эндокринная система.
Гипоталамо-гипофизарно-тиреоидная система
См: Рис. 27.1(Lvn). Гипоталамо-гипофизарно-тиреоидная система
Главным стимулятором секреции Т4 и Т3 является ТТГ . В свою очередь, секреция ТТГ контролируется двумя механизмами:
1. Пептидный гормон тиролиберин образуется в серобугорных ядрах гипоталамуса и поступает в воротную систему гипофиза . Тиролиберин стимулирует синтез и секрецию ТТГ в аденогипофизе .
2. Тиреоидные гормоны непосредственно ингибируют секрецию ТТГ по принципу отрицательной обратной связи, воздействуя на тиреотропные клетки аденогипофиза . T4 и T3 могут влиять и на секрецию тиролиберина , но является ли их эффект стимулирующим или ингибирующим - неизвестно. Поэтому считается, что основной мишенью отрицательного регуляторного действия Т4 и Т3 является именно аденогипофиз. Регуляторные взаимоотношения в гипоталамо-гипофизарно-тиреоидной системе представлены на рис. 27.1 . Кроме тиролиберина и тиреоидных гормонов на секрецию ТТГ прямо или косвенно влияют и многие другие факторы, но их роль не столь значительна.
3.1. Гормоны гипоталамуса.
3.2.Гормоны гипофиза.
3.3.Гормоны щитовидной и паращитовидной желез.
3.3.1.Биосинтез и транспорт иодсодержащих гормонов
Гормоны щитовидной железы: транспорт и метаболизм
От половины до двух третей Т4 и Т3 присутствует в организме вне щитовидной железы, причем большая часть их находится в крови в связанной форме в комплексе с двумя белками:
тироксин-связывающим глобулином ( ТСГ ) и тироксин-связывающим преальбумином ( ТСПА ). В количественном отношении большее значение имеет ТСГ
Биологическая активность гормонов обуславливается небольшой несвязанной (свободной) фракцией. Несмотря на значительные различия в общем количестве гормонов, свободная фракция Т3 близка к таковой Т4 , однако время полужизни Т4 в плазме в 4-5 раз больше, чем Т3.
Другие пути метаболизма тиреоидных гормонов включают полное деиодирование или инактивацию посредством дезаминирования или декарбоксилирования. Образование конъюгатов в печени (глюкуронидация и сульфирование) приводит к формированию более гидрофильных молекул, которые выделяются в желчь , вновь всасываются в кишечнике, деиодируются в почках и выделяются с мочой.
Тиреоидные гормоны: механизм действия
Гормоны щитовидной железы с высоким сродством связываются с ядерными рецепторами клеток - мишеней. Сродство Т3 примерно в 10 раз превышает сродство Т4 . Вопрос о том, принадлежит ли вся гормональная активность щитовидной железы только Т3, остается спорным; активностью, по-видимому, обладают оба гормона, и Т3 и Т4. Сравнение различных гормональных аналогов выявляет высокую корреляцию между их сродством к рецепторам и способностью вызывать биологическую реакцию. Тиреоидные гормоны взаимодействуют и с низкоаффинными связывающими участками в цитоплазме, которые, очевидно, не тождественны белку ядерного рецептора. Цитоплазматическое связывание может служить для удержания гормонов поблизости от истинных рецепторов. Описано связывание Т3# с плазматическими мембранами, роль этого феномена в транспорте гормона не ясна.
Главная метаболическая функция гормонов щитовидной железы состоит в повышении поглощения кислорода . Эффект наблюдается во всех органах, кроме мозга, ретикулоэндотелиальной системы и гонад. Особое внимание привлекают к себе митохондрии , в которых Т4 вызывает морфологические изменения и разобщает окислительное фосфорилирование . Эти эффекты требуют больших количеств гормона и почти наверняка не имеют места в физиологических условиях.
Тиреоидные гормоны индуцируют митохондриальную альфа-глицеро- фосфатдегидрогеназу , что, возможно, связано с их действием на поглощение кислорода.
Согласно гипотезе Эдельмана , большая часть энергии, утилизируемой клеткой , используется для работы Na/K-АТРазного насоса . Гормоны щитовидной железы повышают эффективность этого насоса, увеличивая количество составляющих его единиц. Поскольку все клетки обладают таким насосом и практически каждая из них реагирует на тиреоидные гормоны, повышенная утилизация АТР и связанное с нею увеличение потребления кислорода в процессе окислительного фосфорилирования могут представлять собою основной механизм действия этих гормонов.
Гормоны щитовидной железы, подобно стероидам, индуцируют синтез белков путем активации механизма генной транскрипции ( рис 6-7сер ). По-видимому, именно таков механизм, посредством которого Т3 усиливает общий синтез белка и обеспечивает положительный азотный баланс.
Здесь вновь проявляется любопытная связь между двумя группами гормонов, оказывающих влияние на рост: тиреоидными гормонами и гормонами роста. Т3 и глюкокортикоиды повышают уровень транскрипции гена гормона роста , увеличивая тем самым образование последнего.Это объясняет классическое наблюдение, согласно которому в гипофизе животных с дефицитом Т3 отсутствует гормон роста. Аналогичным образом можно трактовать некоторые общие анаболические эффекты Т3. Очень высокие концентрации Т3 подавляют синтез белка и обуславливают отрицательный азотный баланс.
Гормоны щитовидной железы известны как важные модуляторы процессов развития . Это особенно ярко проявляется в их действии на метаморфоз амфибий. Тиреоидные гормоны необходимы для превращения головастика в лягушку. Этот процесс включаетрезорбцию хвоста, пролиферацию зачатков конечностей, замену эмбриональной формы гемоглобина на взрослую, стимуляцию ферментов цикла мочевины (так что выделение мочевины начинает преобладать над выделением аммиака) и изменения эпидермиса.
Гормоны щитовидной железы необходимы и для нормального развития человека. Гипотиреоз у плодов или новорожденных приводит к кретинизму , который характеризуется множественными врожденными нарушениями и тяжелой необратимой задержкой умственного развития.
Гормоны щитовидной железы: регуляция синтеза и высвобождения
Главные компоненты, составляющие петлю отрицательной обратной связи, - это Т4 , Т3 , тиреотропин и тиролиберин ( рис. 46.4бх ). Т4 и Т3тормозят свой собственный синтез по механизму обратной связи. Медиатором этого процесса может служить Т3, поскольку Т4 превращается в гипофизе в Т3. На этом уровне обратная связь ингибирует высвобождение тиреотропина . Т3 (или, возможно,Т4) может подавлять высвобождение и образование тиролиберина гипоталамусом. Стимулом для повышенной секреции тиролиберина и тиреотропина служит снижение содержания тиреоидных гормонов в крови.
Однако даже при полной блокаде биосинтеза тиреоидных гормонов (например, при лечении антиреоидными средствами) не происходит немедленного усиления высвобождения тиролиберина и тиреотропина. Щитовидная железа содержит запас ранее образованного гормона, обеспечивающий его "поставку" в течение нескольких недель; имеются также внетиреоидные резервы гормона (в печени и в связанной с ТСГ форме), которые расходуются в первую очередь. Кроме того, при угрозе снижения биосинтеза гормона связи с недостаточностью иода дополнительную компенсаторную роль выполняет ауторегуляторный механизм щитовидной железы.
Существует интересное взаимодействие петель отрицательной обратной связи для щитовидной железы и гормона роста , обусловливающее регуляторные механизмы, представленные на рис. 46.4бх .
Т3 и Т4 усиливают высвобождение соматостатина из гипоталамуса, а этот пептид ингибирует секрецию тиреотропина гипофизом. Соматостатин участвует и в другом механизме: его уровень возрастает в ответ на повышение содержания в плазме инсулиноподобного фактора роста ( ИФР-1 ), которое в свою очередь стимулируется гормоном роста ( рис. 45.5бх ).
У малорослых детей , получающих гормон роста, иногда развивается гипотериоз , по-видимому, вследствие увеличения концентрации ИФР- 1, повышающего секрецию соматостатина, что в свою очередь сопровождается падением секреции тиреотропина.
3.4. Гормоны надпочечников.
3.4.1.Гормоны коры надпочечников.
3.4.2.Гормоны мозгового слоя надпочечников.
З.5.Физиологическое значение гормонов в норме и патологии.