
- •2.1.Молекулярный механизм действия катехоламинов на сердце и
- •2.3.Механизм действия активаторов аденилатциклазы и цАмф на
- •Обмен кальциевый внутриклеточный: влияние активаторов аденилатциклазы
- •2.4.Предсердный натрийуретический пептид (anf). Мембранносвязанная гуанилатциклаза. Строение и механизм функционирования тирозинкиназного рецептора.
- •2.5.Растворимая форма гуанилатциклазы. Активаторы растворимой формы гуанилатциклазы
- •2.6.Роль цГмф и протеинкиназы g в регуляции кальциевого обмена в кардиомиоцитах и гладкомышечных клетках.
- •Классификация
2.4.Предсердный натрийуретический пептид (anf). Мембранносвязанная гуанилатциклаза. Строение и механизм функционирования тирозинкиназного рецептора.
ANP - гормон белковой природы, синтезируемый в миоцитах предсердия как прогормон, и накапливающийся в секреторных гранулах в виде белковой цепочки длиной в 126 аминокислотных остатка. Небольшие количества образуются в клетках желудочков. Некоторые количества ANP синтезируются в легких и нейронами центральной и периферической нервной систем. ANP секретируется в ответ на растяжение предсердий (увеличение объема внутрисосудистой жидкости при различных патологических состояниях, изменение положения тела из вертикального в горизонтальное, физическая нагрузка).
Выработка ANP возрастает под влиянием глюкокортикоидов, -адренорецепторов. Первичной тканью-мишенью длявазопрессина, эндотелина или ANP служат почки, но он действует также на периферическое сопротивление артерий. В почках ANP усиливает тонус приводящих артериол, тем самым повышает давление в клубочке, т.е. увеличивает фильтрационное давление. ANP способен сам по себе усиливать фильтрацию, даже если внутриклубочковое давление не меняется. Это приводит к увеличению экскреции натрия вместе с большим количеством первичной мочи. Увеличение экскреции натрия дополнительно обусловлено подавлением ANP секреции ренина юкстагломерулярным аппаратом. Также экскреция натрия усиливается путем прямого действия ANP на проксимальные канальцы нефрона и непрямого ингибирования синтеза и секреции альдостерона. ANP ингибирует секрецию вазопрессина из задней доли гипофиза. Все эти механизмы в конечном счете направлены на то, чтобы вернуть к норме увеличенное количество натрия и увеличенный объем воды в организме, возникшие в результате патологических воздействий. Факторы, активирующие ANP, противоположны тем, которые стимулируют образование ангиотензина II.
В плазме крови ANP находится в виде нескольких форм прогормона. При освобождении прогормон выделяется в эквимолярных количествах в виде proANP (99-126) с высокой биологической активностью, также известным как - -ANP связывается с-ANP (ANP 1-28), и N-терминальной части - proANP (1-98). -ANP составляет 3-4 минуты.определенными рецепторами. Период полураспада Никакие рецепторы для proANP (1-98) на сегодняшний день неизвестны, и этот пептид циркулирует дольше, что ведет к существенно более высоким концентрациям в -ANP.крови по сравнению с
В клинических исследованиях было показано, что уровень proANP (1-98) в плазме -ANP в раннем периоде сердечной дисфункции. Такимв 50 раз выше, чем уровень образом, уровень proANP (1-98) менее чувствителен к пульсации секреции ANP и может лучше отражать постоянную секрецию ANP, чем быстро колеблющиеся уровни -ANP. ProANP (1-98) далее расщепляется на две формы: proANP (1-30) и proANP (31-67). ProANP (31-67) является предоминантным иммунореактивным эпитопом в моче.
Концентрация ANP в плазме повышается у пациентов с недостаточностью митрального клапана, остановкой сердца, прогрессирующим ухудшением гемодинамики. У беременных с преэклампсией концентрация proANP резко повышается.
Следует отметить, что стабильность proANP и proBNP очень высока: в образцах плазмы белок стабилен три дня при комнатной температуре, что позволяет направить пробу на исследование этого показателя даже на следующий день. В отличие от -ANP, требующих твердофазноймногих тест-систем для определения BNP-32 и экстракции образца перед анализом, proANP и proBNP могут быть определены непосредственно в биологическом образ
Гуанилатциклаза
Гуанилатциклаза принимает участие в синтезе цГМФ , являющимся одним из важных посредников внутриклеточной передачи сигналов.
Особенности регуляции гуанилатциклазы позволяют ей осуществлять связь между системами обмена цАМФ , кальция , и окислительно-восстановительной системой .
В отличие от аденилатциклазы , которая локализована в плазматической мембране, гуанилатциклаза, синтезирующая цГМФ из ГТФ, находится как в мембраносвязанном, так и в растворимом состоянии. Соотношенния этих двух форм фермента в различных тканях разные. Так, например, 90% активности гуанилатциклазы клеток тонкого кишечника выявляется в мембранной фракции, а 10% - в цитозоле. В легких и печени лишь 20% активности гуанилатциклазы находится в мембранах, а 80% - в цитозоле.
Молекулярные веса растворимой и связанной с мембранами гуанилатциклазы разные. Показано, что некоторые внеклеточные регуляторы могут влиять на перераспределение гуанилтциклазы между мембранами и цитоплазмой. Поскольку отщепление от мембран, как правило, активирует фермент, воздействие на компартментализацию гуанилатциклазы может быть важным регуляторным фактором, изменяющим содержание цГМФ в клетке.
Гуанилатциклазу удается выявить в различных субклеточных структурах, например в тщательно очищенных ядрах печени и матки. Изменение функционального состояния ткани также влияет на внутриклеточную локализацию гуанилатциклазы. При регенерации печени отмечается 2-3 - кратное повышение активности фермента в мембранах, в том числе и ядерных.
Активность гуанилатциклазы в разных тканях не превышает 1-2 пмоль мг/белка в 1 мин. Это объясняется , по-видимому, крайне низким содержанием фермента. Концентрация цГМФ в клетке также низка - около 10-7М. При активации синтеза или подавлении распада цГМФ концентрация этого нуклеотида в клетке обычно повышается в 3-8 раз.
циклический гуанозинмонофосфат (цГМФ) рассматривался как антипод цАМФ. Ему приписывали функции, противоположные цАМФ. К настоящему времени получено много данных, что цГМФ принадлежит самостоятельная роль в регуляции функции клеток. В частности, в почках и кишечнике он контролирует ионный транспорт и обмен воды, в сердечной мышце служит сигналом релаксации и т.д.
Биосинтез цГМФ из ГТФ осуществляется под действием специфической гуанилатциклазы по аналогии с синтезом цАМФ:
![]()
Известны четыре разные формы гуанилатциклазы, три из которых являются мембраносвязанными и одна – растворимая открыта в цитозоле. Показано, что мембраносвязанные формы (мол. массой ~ 180000) состоят из 3 участков: рецепторного, локализованного на внешней поверхности плазматической мембраны; внутримембранного домена и каталитического компонента, одинакового у разных форм фермента. Гуанилатциклаза открыта во многих органах (сердце, легкие, почки, надпочечники, эндотелий кишечника, сетчатка и др.), что свидетельствует о широком ее участии в регуляции внутриклеточного метаболизма, опосредованном через цГМФ. Мембраносвязанный фермент активируется через соответствующие рецепторы короткими внеклеточными пептидами (18–20 аминокислотных остатков), в частности гормоном предсердным натрийуретическим пептидом (АНФ), термостабильным токсином грамотрицательных бактерий и др. АНФ, как известно, синтезируется в предсердии в ответ на увеличение объема крови, поступает с кровью в почки, активирует гуанилатциклазу (соответственно повышает уровень цГМФ), способствуя экскреции Na и воды. Гладкие мышечные клетки сосудов также содержат аналогичную рецептор-гуанилатциклазную систему, посредством которой связанный с рецептором АНФ оказывает сосудорасширяющее действие, способствуя снижению кровяного давления. В эпителиальных клетках кишечника активатором рецептор–гуанилатциклазной системы может служить бактериальный эндотоксин, который приводит к замедлению всасывания воды в кишечнике и развитию диареи.
Растворимая форма гуанилатциклазы (мол. масса 152000) является гемсодержащим ферментом, состоящим из 2 субъединиц. В регуляции этой формы гуанилатциклазы принимают участие нитровазодилататоры, свободные радикалы – продукты перекисного окисления липидов. Одним из хорошо известных активаторов является эндотелиальный фактор (EDRF), вызывающий релаксацию сосудов. Действующим компонентом, естественным лигандом, этого фактора служит оксид азота NO. Эта форма фермента активируется также некоторыми нитрозовазодилататорами (нитроглицерин, нитропруссид и др.), используемыми при болезнях сердца; при распаде этих препаратов также освобождается NO.
Оксид азота образуется из аминокислоты аргинина при участии сложной Са2+-зависимой ферментной системы со смешанной функцией, названной NO-синтазой:
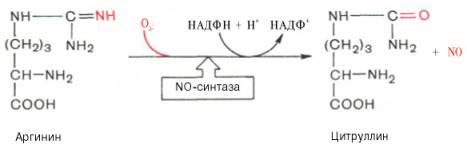
Оксид азота при взаимодействии с гемом гуанилатциклазы способствует быстрому образованию цГМФ, который снижает силу сердечных сокращений путем стимулирования ионных насосов, функционирующих при низких концентрациях Са2+. Однако действие NO кратковременное, несколько секунд, локализованное – вблизи места его синтеза. Подобный эффект, но более длительный оказывает нитроглицерин, который медленнее освобождает NO.
Получены доказательства, что большинство эффектов цГМФ опосредовано через цГМФ-зависимую протеинкиназу, названную протеинкина-зой G. Этот широко распространенный в эукариотических клетках фермент получен в чистом виде (мол. масса 80000). Он состоит из 2 субъединиц – каталитического домена с последовательностью, аналогичной последовательности С-субъединицы протеинкиназы А (цАМФ-зависимой), и регуля-торного домена, сходного с R-субъединицей протеинкиназы А (см. ранее). Однако протеинкиназы А и G узнают разные последовательности белков, регулируя соответственно фосфорилирование ОН-группы серина и треонина разных внутриклеточных белков и оказывая тем самым разные биологические эффекты.
Уровень циклических нуклеотидов цАМФ и цГМФ в клетке контролируется соответствующими фосфодиэстеразами, катализирующими их гидролиз до 5'-нуклеотидмонофосфатов и различающимися по сродству к цАМФ и цГМФ. Выделены и охарактеризованы растворимая кальмоду-линзависимая фосфодиэстераза и мембраносвязанная изоформа, не регулируемая Са2+ и кальмодулином.
Данная группа рецепторов опосредует сигнал от ряда эндогенных веществ, включающих инсулин, эпидермальный фактор роста (EGF), тромбоцитарный фактор роста (platelet-derived growth factor — PDGF)- Эти рецепторы сформированы одной полипептидной цепью, которая пронизывает цитоплазматическую мембрану, образуя три домена: лигандсвязываюший экстрацеллюлярный, трансмембранный и интрацеллюлярный, который содержит участок, обеспечивающий ферментативную активность (см. рис. 1.1). Некоторые из этих рецепторов, например инсулиновый, существуют в виде димеров из двух рецепторов, сопряженных друг с другом нековалентными связями. Другие, такие, как EGF-рецептор, существуют внутри мембраны в единичной форме и образуют димер в ответ на присоединение лиганда к каждой субъединице. В любом случае связывание фактора роста с рецептором приводит к аллостерической активации тирозинкиназной активности в цитоплазматическом домене рецептора.
Первый шаг в этой активации включает перекрестное фосфорилирование множественных остатков тирозина двух рецепторных субъединиц внутри интрацеллюлярного домена. Это автофосформатирование действует как сигнал к связыванию других внутриклеточных белков, тирозиновые остатки которых фосфорилируются рецептором и таким образом активируются. Специфичность клеточного ответа детерминируется специфичными для данной клетки комбинациями белков, которые присоединяются к рецепторам факторов роста.
В последнее время большое количество белков, присоединяющихся к активированным рецепторам факторов роста, было идентифицировано. Имея различную структуру, эти белки включают два консервативных домена, известных как SH2 и SH3 (Sre homology region). Впервые они были выявлены в протоонкогене, названном Sre-белок, отсюда и название; SН2-домены распознают фосфотирозины на рецепторах факторов роста, функции SНЗ-доменов пока не ясны.
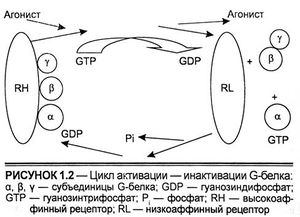
Характеристика белков, содержащих SH2- и SНЗ-домены, является сегодня предметом многих исследований. Роль некоторых из них показана. Например, одним из механизмов, которым факторы роста регулируют клеточный рост и дифференцировку, является активация каскада протеинкиназ, известных как митогенактивируемые протеинкиназы (mitogen activated protein kinas — MAP kinase pathway). Активация этого пути инициируется фосфорилированием тирозинов белка Grb2, содержащего SH2- и SНЗ-домены. SH3-домен на Grb2 присоединяет другой белок, известный как mSOS, и совместно комплекс Grb2/ mSOS активирует Ras, мономерный G-белок. Ras имеет структуру, аналогичную α-субъединице G-белков, которая взаимодействует с 7-трансмембранными (сопряженными с G-белками) рецепторами и активируется и инактивируется сходными механизмами (рис. 1.2). Отсюда взаимодействие Ras с Grb2/mSOS ускоряет обмен ГДФ на ГТФ на Ras, стимулируя его активацию.
![]()
Цикл активации-инактивации G-белка
Следующий шаг в этом каскаде включает, по-видимому, активацию Ras серин/треонинкиназы, известную как Raf, которая затем активирует фосфорилированием другую киназу, МЕК (известную как МАР-киназная киназа), которая в свою очередь фосфорилирует МАР-киназу, которая способна проходить через ядерную мембрану, и в ядре она фосфорилирует различные факторы транскрипции. Возникающие изменения транскрипции гена инициируют процессы пролиферации или дифференцировки.
Другие белки, взаимодействующие с рецепторами факторов роста, способны регулировать внутриклеточные вторичные мессенджеры. Например, члены семейства фосфолипазы с-у, которые регулируют уровень внутриклеточного IP3 и диацилглицерола, как и семейство PLC-P, рассмотренные выше, содержат SH2- и SН3-домены и могут быть активированы тирозинкиназными рецепторами. Пока из рецепторов факторов роста только инсулиновые используются как фармакологические мишени у больных диабетом. Однако роль этих рецепторов в клеточном росте, неконтролируемое проведение через них сигналов при воспалительных и неопластических заболеваниях определяют большой интерес к разработке блокирующих их активность агентов. Например, мутантные Ras-белки были обнаружены более чем в 30 % опухолей человека, поэтому в настоящее время в качестве препаратов лечения опухолей разрабатываются вещества, способные ингибировать мутантные белки Ras и другие в МАР-киназном пути.
Поскольку рецепторные протеинкиназы фосфорилируют белки по тирозиновым остаткам, их относят к тирозинкиназам и называют рецепторами тирозинкиназными ( RTK )
Существует 19 классов рецепторных тирозинкиназ, выделяемых на основе гомологии первичной структуры, структурных характеристик и аминокислотных мотивов цитоплазматического домена, их основные типы представлены на рис 2 [ Wilks A.F., 1993 , Shawver L.K et al, 1995 ].
Это большие белки. Так, рецептор эпидермального фактора роста состоит из 1186 аминокислот.
Эти рецепторы один раз проходят через мембрану. К середине 90-х годов выявлено четыре подтипа рецепторов типа тирозинкиназы (см. рис. 8. Рецепторы тирозинкиназные) и рис 7-5 - схема активации тирозинкиназных рецепторов.
Рецепторы ростовых факторов 1 типа с протинкиназной активностью
Рецепторы ростовых факторов 2 типа с протеинкиназной активностью
Рецепторы ростовых факторов 3 типа с протеинкиназной активностью
Рецепторы ростовых факторов 4 типа с протеинкиназной активностью
Действие рецептора определяется не только его принадлежностью к данному типу, но и субстратной специфичностью его тирозинкиназного домена.
В случае эпидермального фактора роста и фактора роста из тромбоцитов показано, что их рецепторы фосфорилируют гамма-1- изоформу фосфолипазы С , что приводит к ее активации [ Pandiella et al., 1989 ]. Также фосфорилируются белки 3-киназа фосфатидининозитола , активатор ГТФазы белка ras ( GAP белок ), киназы белков МАР , киназы белков raf , липокортин и белок c-crb B-2 [ Carpenter, Cohen,1990 ].
RTK активируются лигандами, димеризуются и фосфорилируют внутриклеточные субстраты, порождая мощный сигнал, управляющий важными клеточными реакциями: пролиферацией , дифференцировкой , метаболизмом и генной экспрессией.
Многие RTK вовлечены в процессы злокачественного роста . Мутировавшие RTK могут генерировать внутриклеточный сигнал пролиферации и в отсутствии лиганда. Так, фактор роста, кодируемый NEW локусом, участвует в развитии рака легких .
Другие мутантные рецепторы факторов роста могут блокировать дифференцировку определенных типов клеток.
Структура и функционированние RTK рецепторов показано на рис.mb20-28 . Для них характерно аутофосфорилирование , играющее большую роль в передаче сигнала.
С цитозольным доменом RTK связываются два типа белков, содержащие
SH2-домен , специфичные к фосфотирозиновым остаткам в активированных RTK:
адапторные белки GRB2 , соединяющие рецептор с другими белками, но сами не передающие сигнала.
ферменты, связывающиеся с SH2 доменами, вовлеченные в сигнал-передающие пути: GAP , Syp фосфотаза , PI3 киназа , PLC гамма
Общим свойством рецепторов фактров роста является их склонность к димеризации и аутофосфорилированию.
Все известные клеточные рецепторы факторов роста относятся к группе каталитических: они обладают тирозинкиназной активностью, ( RTK рецепторы) индуцируемой связыванием лиганда, и имеют соответствующий каталитический домен.
Эти рецепторы являются мультидоменными белками, с Mr около 190kDa, однократно пронизывающими плазматическую мембрану (кроме класса 3, см. рис. 8 )
Надмембраная часть рецепторов содержит либо области, обогащенные Cys (классы 1-3),либо домены, аналогичные иммуноглобулинам (классы 4,5).
Далее следуют гидрофобный трансмембранный домен и подмембранный домен, различающийся у представителей разных классов, однако консервативный в пределах класса.
Подмембранные домены могут содержать оксиаминокислоты , фосфорилирование/дефосфорилирование которых модулирует различные аспекты передачи сигнала.
Интересный пример взаимодействия на этом уровне был описан для EGF-R и PDGF-R ( Lin H. ea, 1986 , цит по Ullrich A. and Schlessinger J., 1990 ): активация PDGF-R вела к ослабленному клеточному ответу на EGF . Выясилось, что PDGF-R активирует PKC ( рис. 12 ), которая в свою очередь фосфорилирует Thr 654 в подмембранном домене EGF-R. Это приводит к невозможности активации EGF-R, притом его сродство к лиганду не меняется.
Цитоплазматический тирозинкиназный домен является самой консервативной областью рецепторов. Он содержит сайт связывания ATP . У рецепторов классов 4 и 5 каталитический домен разделен на две части вставочной областью - до 100 гидрофильных аминокислотных остатка.
Показано, что каталитический домен всех факторов роста ( GF-R ) содержит по крайней мере один остаток Tyr (Tyr 857 для PDGF-R, Kazlauskas A. and Cooper J.A., 1989 ), фосфорилирование которого регулирует киназную активность рецептора.
Вставочная область (классы 4, 5) также содержит Tyr (751 для PDGF-R, Kazlauskas A. and Cooper J.A., 1989 ), ответственый за ассоциацию рецептора с клеточными субстратами. В случае PDGF-R было показано, что вставочная область рецептора необходима для генерирования полного клеточного ответа на стимуляцию. Рецептор с мутацией в этом районе не индуцировал синтеза ДНК в клетках (линия СНО, Escobedo J. ea, 1988 ), однако повышение концентрации фосфоинозитидов имело место. см. рецепторные тирозинкиназы
Все рецепторные тирозинкиназы имеют сходное строение - состоят из лигандсвязывающего внеклеточного участка, гидрофобного трансмембранного домена и внутриклеточной (цитоплазматической) области. Последняя наряду с каталитическим тирозинкиназным доменом содержит регуляторные зоны.
Рецепторы с тирозинкиназной активностью
Тирозиновые протеинкиназы - ферменты, фосфорилирующие специфические белки по тирозину, подразделяют на 2 типа - мембранные (рецепторные) и цитоплазматические. Внутриклеточные тирозиновые протеинкиназы принимают участие в процессах передачи сигнала в ядро. Рецепторные тирозиновые протеинкиназы участвуют в трансмембранной передаче сигналов.
Примером рецепторной тирозиновой протеинкиназы может служить рецептор инсулина (рис. 5-31). Рецептор инсулина - тирозиновая протеинкиназа, фосфорилирующая белки по ОН-группам тирозина.
Рецептор состоит из двух α- и двух β-субъединиц, связанных дисульфидными связями и нековалентными взаимодействиями, α- и β-Субъединицы - гликопротеины с углеводной частью на наружной стороне мембраны. Вне мембраны на её поверхности находятся α-субъединицы. Центр связывания инсулина образован N-концевыми доменами α-субъединиц. β-Субъединицы пронизывают мембранный бислой и не участвуют в связывании инсулина.
Каталитический центр тирозиновой протеинкиназы находится на внутриклеточных доменах β-субъединиц. В отсутствие гормона инсулиновые рецепторы не проявляют тирозинкиназной активности. Присоединение инсулина к центру связывания на α-субъединицах активирует фермент, причём субстратом служит сама тирозиновая протеинкиназа (β-субъединицы), т.е. происходит фоСфорилирование β-субъединицы по нескольким тирозиновым остаткам. Фосфорилирование β-субъединиц происходит по механизму межмолекулярного трансфосфорилирования, т.е. одна β-цепь фосфорилирует другую β-цепь той же молекулы рецептора. Это, в свою очередь, приводит к изменению субстратной специфичности тирозиновой протеинкиназы; теперь она способна фосфорилировать другие внутриклеточные белки. Активация и изменение специфичности обусловлены конформационными изменениями рецептора инсулина после связывания гормона и аутофосфорилирования.
Ключевой белок, фосфорилируемый тирозиновой протеинкиназой, - субстрат инсулинового рецептора-1 (от англ, insulin receptor substrate, IRS-I). Фосфорилированный IRS-I активирует ферменты, например тирозиновую фосфопротеинфосфатазу,
