
- •2.1.Молекулярный механизм действия катехоламинов на сердце и
- •2.3.Механизм действия активаторов аденилатциклазы и цАмф на
- •Обмен кальциевый внутриклеточный: влияние активаторов аденилатциклазы
- •2.4.Предсердный натрийуретический пептид (anf). Мембранносвязанная гуанилатциклаза. Строение и механизм функционирования тирозинкиназного рецептора.
- •2.5.Растворимая форма гуанилатциклазы. Активаторы растворимой формы гуанилатциклазы
- •2.6.Роль цГмф и протеинкиназы g в регуляции кальциевого обмена в кардиомиоцитах и гладкомышечных клетках.
- •Классификация
Сердечно-сосудистая система
Лекция 2. Молекулярные механизмы действия медиаторов парасимпатической и симпатической системы на сердце и сосуды.
2.1.Молекулярный механизм действия катехоламинов на сердце и
сосуды через α и β-адренергические рецепторы.
2.2.Молекулярный механизм действия ацетилхолина на
кардиомиоциты и гладкомышечные клетки.
2.3.Механизм действия активаторов аденилатциклазы и цАМФ на
внутриклеточный обмен в сердце и сосудах. Роль протеинкиназы А.
2.4.Предсердный натрийуретический пептид (ANF). Мембранносвязанная гуанилатциклаза. Строение и механизм функционирования тирозинкиназного рецептора.
2.5.Растворимая форма гуанилатциклазы. Активаторы растворимой формы гуанилатциклазы.
2.6.Роль цГМФ и протеинкиназы G в регуляции кальциевого обмена в кардиомиоцитах и гладкомышечных клетках.
2.7.МО-синтетаза. Механизм образования окиси азота в кардиомиоцитах и гладкомышечных клетках.
* * * *
2.1.Молекулярный механизм действия катехоламинов на сердце и
сосуды через α и β-адренергические рецепторы.
Основными эндогенными катехоламинами, регулирующими функции и метаболизм органов за счет влияния на адренергические синапсы и АР, являются адреналин и норадреналин. Термин "норадреналин" происходит от условного сокращения немецкого "Nо hue Radikale = Nor", т. е. адреналин с азотом без радикала (метильного). В иностранной литературе вместо адреналина употребляется термин "эпинефрин" (греч. epi — на, над; nephros — почка), а вместо норадреналина — "норэпинефрин".
По химическому строению адреналин и норадреналин являются аминами, у которых Nfy-rpynna связана через этильный радикал с пирокатехином (катехолом, ортодиоксибензолом), т. е. эти катехола-мины можно считать производными пирокатехинэтиламина:
По химическому строению адреналин и норадреналин близки друг к другу: молекулы обоих веществ содержат в р-положении гидро-ксильную группу и различаются лишь наличием у адреналина метальной 1руппы при атоме азота аминогруппы:
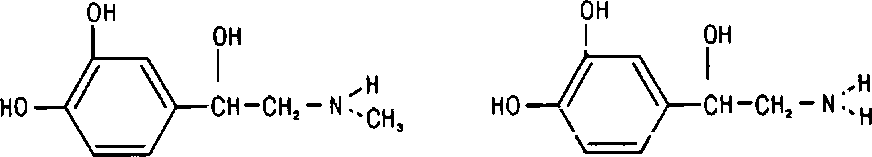
АНДРЕНАЛИН НОРАДРЕНАЛИН
Адренергические синапсы
Синапс (греч. synapsis — соединение) представляет собой структурное образование на месте контакта одного нейрона с другим или окончания эфферентного нерва с клеткой эффекторного органа. Синапс состоит из трех основных элементов: пресинаптической мембраны, синаптической щели и постсинаптической мембраны, выполняющих определенные функции.
В области пресинаптической мембраны синтезируются и выделяются медиаторы, оказывающие возбуждающее или тормозящее действие на постсинаптическую мембрану иннервируемой клетки. Постсинаптическая мембрана обладает избирательной чувствительностью к химическому агенту — медиатору и практически не чувствительна к раздражению электрическим током. Избирательная чувствительность этой мембраны к определенным химическим веществам и медиаторам объясняется наличием на ее поверхности рецепторов — молекул, обладающих свойствами специфического взаимодействия с молекулами медиатора. Помимо постсинаптической мембраны, рецепторы к медиатору могут находиться и в других отдельных от синапса областях поверхности мембраны.
В регуляции функций организма принимают участие синапсы, содержащие медиаторы разного химического строения. Синапсы, в которых медиатором является норадреналин, получили название адренергических (более точно норадренергических) синапсов, а рецепторные структуры, реагирующие на норадреналин и адреналин, называют АР.
Синтез катехоламинов является ферментативным процессом (схема 7). Все ферменты, принимающие в нем участие, синтезируются в эндоплазматическом ретикулуме
тела нервной клетки. С естественным током аксоплазмы они переносятся по аксону к нервному окончанию, где происходят все этапы синтеза катехоламинов.
Этап 1. Превращение тирозина в 3,4-диоксифенилаланин (ДОФА) осуществляется с помощью диффузно-распределенного по нервному окончанию фермента тирозингидроксилазы, которая обнаружена только в надпочечниках и в нервных окончаниях катехоламинергических нейронов. Для протекания этой реакции необходимо наличие молекулярного кислорода, Fe2+ и птеридина. Стадия образования ДОФА из тирозина является самой медленной, т. е. лимитирующей реакцией в биосинтезе норадреналина. Регуляция биосинтеза катехоламинов во многом определяется влиянием именно на стадию превращения тирозина в ДОФА.
Важным моментом является тот факт, что по принципу обратной связи избыток конечных продуктов реакции (норадреналина и дофамина) может тормозить, а недостаток свободных катехоламинов увеличивать активность тирозингидроксилазы.
Кроме аллостерического контроля, активность тирозингидроксилазы может регулироваться посредством фосфорилирования и де-фосфорилирования. Под влиянием фосфорилирования уменьшаются Km для кофактора птеридина и сродство к ингибитору обратной связи, происходит активация фермента. Полагают, что эти процессы происходят с участием цАМФ-зависимых протеинкиназ.
Этап 2 синтеза норадреналина — превращение ДОФА в дофамин (3,4-диоксифенилэтиламин). В ходе этого этапа с помощью фермента ДОФА-декарбоксилазы происходит отщепление карбоксильной группы от молекулы ДОФА. В качестве кофактора в реакции принимает участие производное витамина B6 — пиридоксаль-5-фосфат (B6-пиридоксаль). Недостаток витамина B6 может вызывать торможение реакции превращения ДОФА в дофамин.
Фермент ДОФА-декарбоксилаза, как и тирозингидроксилаза, диффузно распределен по аксоплазме нервного окончания. В отличие от тирозингидроксилазы, он обнаружен, помимо нервной ткани, в печени и почках. Синтез ДОФА и дофамина протекает в аксоплазме нервного окончания возле митохондрий.
Этап 3, на котором заканчивается процесс синтеза медиатора норадреналина в адренергических нервных окончаниях, это его образование из дофамина путем гидроксилирования. Процесс происходит под влиянием дофамин-β-гидроксилазы, которая содержится только в адренергических и норадренергических нейронах и отсутствует в до-фаминергических. Таким образом, этот медьсодержащий фермент можно рассматривать в качестве специфического маркерного фермента. В основном он локализован в везикулах, хотя частично находится и в цитоплазме.
На стадии образования норадреналина заканчивается процесс биосинтеза катехоламинов в симпатических нервных окончаниях. В хромаффинных клетках мозгового слоя надпочечника он продолжается до образования адреналина. Процесс превращения норадреналина в адреналин катализируется цитозольным ферментом фенилэтаноламин-N-метилтрансферазой, который, помимо мозгового слоя надпочечников, может присутствовать в небольших количествах в нервных окончаниях.
Строение и функции синаптических пузырьков
Норадреналин находится в нервном окончании в двух основных формах — свободной и связанной. Свободный норадреналин, не связанный с какими-либо структурами, состоит из вновь синтезированного норадреналина в цитоплазме нервных клеток и обратно захваченного из синаптической щели. Его количество составляет 10-20 % от всего норадреналин, находящегося в нервных окончаниях. Связанный норадреналин включает прочно связанный норадреналин, локализованный в крупных синаптических пузырьках, и лабильно связанный, локализованный в малых синаптических пузырьках. Связанный норадреналин в синаптических пузырьках, как и свободный, состоит из вновь синтезированного и захваченного из аксоплазмы нервных клеток.
Синаптические пузырьки (везикулы) играют центральную роль в процессах образования, хранения и выброса медиатора в синаптическую щель. Они образуются в теле нервной клетки с участием аппарата Гольджи и с током аксоплазмы поступают в нервное окончание. Различают два вида синаптических пузырьков: крупные (диаметром 80-120 нм), составляющие 4-5 % от общего количества синаптических пузырьков в нервных окончаниях, и малые (диаметром 40-50 нм). Помимо размеров синаптические пузырьки отличаются друг от друга выполняемыми функциями: в крупных пузырьках происходит заключительный этап биосинтеза норадреналин; малые синаптические пузырьки в основном накапливают норадреналин и участвуют в его секреции в синаптическую щель. Биохимический анализ показал, что состав и свойства различных адренергических синаптических пузырьков сходны с составом и свойствами хорошо изученных хромаффинных гранул клеток мозгового слоя надпочечников.
Хромаффинные гранулы представляют себой органеллы, окруженные мембраной, и содержат липиды (холестерин), различные белки, включая Н+-АТФазу (АТФазу протонного насоса), белок-переносчик катехоламинов, белок—переносчик нуклеотидов, цитохром Ь-561, актин, различные гликопротеины (ориентированные внутрь клетки), дофамин-р-гидроксилазу. Очищенные хромаффинные гранулы содержат (от общей сухой массы): катехоламины (адреналин + норадреналин) - 20 96; нуклеотиды (70 % АТФ, АДФ и др.) - 15 %; белки (25 %хромогранин А и др.) — 35 96; аскорбиновая кислота — 0,8 96; энкефалины — 0,5 %, а также небольшие количества различных ионов, в том числе Са2+.
Катехоламины и нуклеотиды транспортируются через мембрану в синаптические пузырьки с помощью переносчиков, источником энергии для которых является протонный градиент. Этот градиент создается за счет работы Н+-АТФазы, гидролизующей АТФ на наружной поверхности мембран синаптического пузырька и накачивающей Н+ внутрь его. Последующее движение протонов по электрохимическому градиенту из синаптического пузырька наружу является источником энергии не только для работы переносчиков, но и для транспорта электронов в синаптические пузырьки.
Поступление электронов в синаптические пузырьки сопряжено с выходом протонов и опосредуется локализованным в мембране циторомом Ь-561. Электроны, поступившие в везикулы, необходимы для перезарядки семидегидроаскорбата в аскорбат, являющийся донором электронов в реакции превращения дофамина в норадреналин, катализируемой ферментом дофамин-р-гидроксилазой.
Наличие в нервных окончаниях наряду со свободным связанного норадреналина свидетельствует о существовании динамического равновесия между ними, причем это равновесие значительно сдвинуто в сторону связанного медиатора, находящегося в синаптических пузырьках.
Концентрация норадреналина в синаптических пузырьках и хромаффинных везикулах может в сотни и тысячи раз превышать его содержание в окружающей среде. Значительная разница в концентрации норадреналина в синаптических пузырьках и окружающей аксоплазме свидетельствует о том, что в синаптических пузырьках существуют специальные механизмы для поглощения норадреналина. Предполагают, что существуют два механизма его поступления в малый синапти-ческий пузырек: пассивный (по градиенту концентрации) и активный (направленный против градиента концентрации) захват. Последний, активный механизм захвата норадреналина, реализуется в присутствии АТФ с участием АТФазы.
Процесс высвобождения норадреналина из нервных окончаний через пресинаптическую мембрану в синаптическую щель происходит путем экзоцитоза, т. е. без предварительного выхода в цитоплазму нервной клетки.
Полагают, что увеличение содержания Са2+ в адренергических окончаниях под влиянием нервного импульса индуцирует секрецию норадреналина из синаптических пузырьков через пресинаптическую мембрану. Са2+ поступает в нервную клетку из внеклеточной жидкости (концентрация Са2+ снаружи примерно в 10 ООО раз больше) после того, как нервный импульс вызывает деполяризацию нервного окончания. При этом уменьшается разность потенциалов на его мембране и открываются зависимые от разности потенциалов кальциевые каналы. Поступивший в ходе деполяризации в нервное окончание Са2+ вызывает высвобождение норадреналина из синаптических пузырьков в синаптическую щель путем экзоцитоза.
Увеличение содержания Са2+ в хромаффинных клетках надпочечника и аксоплазме нервных окончаний приводит, по-видимому, к уменьшению вязкости актин-гранулярного геля, следствием чего является высвобождение гранул (в аксоплазме — синаптических пузырьков) из связи со структурами цитоскелета, которая существует при низких значениях концентрации Са2+ в цитоплазме. В этих условиях хромаф-финные гранулы и синаптические пузырьки получают возможность двигаться в направлении к пресинаптической мембране.
Важную роль в процессе взаимодействия синаптических пузырьков с пресинаптической мембраной играет Са2+. Он активирует сократительные микронити на пресинаптической мембране, в которой при их сокращении образуется отверстие для выделения содержимого синаптических пузырьков. Связываясь с анионными группами на поверхности синаптических пузырьков, Са2+ может уменьшать поверхностное натяжение в мембране, облегчая тем самым выброс содержимого пузырьков.
В последние годы установлены некоторые новые механизмы, участвующие в процессе экзоцитоза.
Экспериментальные данные относительно способности кальмодулина связываться с мембраной синаптических пузырьков и индуцировать избирательное фосфорилирование ее белков, а также способности антител к кальмодулину тормозить процесс экзоцитоза свидетельствуют о том, что активированный кальцием кальмодулин может регулировать этот процесс. В механизме экзоцитоза задействован активируемый кальцием белок синексин, полимеризующийся в присутствии Са2+ в агрегаты, что в свою очередь может вызвать агрегацию отдельных везикул. Полимеры синексина также обладают способностью связываться с определенными фосфолипидами мембран, изменяя их свойства.
После слияния синаптических пузырьков с пресинаптической мембраной и выброса их содержимого в синаптическую щель участки пресинаптической мембраны, встроившиеся в нее в ходе экзоцитоза, подвергаются "вырезанию" и эндоцитозу, после чего пресинаптическая мембрана восстанавливает свои прежние размеры. При этом поступившие обратно в аксоплазму синаптические пузырьки и везикулы повторно используются.
Распределение АР в организме и вызванные ими эффекты
АР широко распространены в организме; по месту локализации различают центральные и периферические АР. Центральные АР, находящиеся в различных областях мозга, участвуют в регуляции функций ЦНС. Периферические АР, регулирующие функции внутренних органов, исследованы более подробно.
Основной вклад в реакцию того или иного органа на катехоламины и адренергические вещества вносят пост- и внесинаптически расположенные АР. В большинстве случаев эти АР локализованы на поверхности гладкомышечных или секреторных клеток органов и тканей и их возбуждение приводит либо к усилению сокращения (или секреции), либо к расслаблению (уменьшению секреции).
-АР делятся на два подтипа: а1- и а2-АР, различающиеся по своей локализации, функции и механизму трансформации биологического сигнала. По расположению в организме различают центральные и периферические а-АР, по локализации в синапсе — пре-, пост- и внесинаптические а-АР.
Широкая распространенность а-АР обусловливает многообразие биологических эффектов, возникающих при их возбуждении или фармакологической блокаде. а,-АР преимущественно локализованы на постсинаптической мембране эффекторных клеток; лишь в последние годы получены доказательства существования пресинаптических а,-АР. Топография постсинаптических а1- и а2-АР, их роль в организме и механизм функционирования различаются (табл. 10).
Таблица 10. Молекулярное строение а-АР
|
сч-АР |
сц-АР |
Химическое строение Молекулярная масса Молекулярные размеры Мембранная организация |
сложный глико протеин 80 000-90 000 дальтон 515 аминокислот (56 000 дальтон) 7 мембраносвязанных доменов, внеклеточный NН2-конец, внутриклеточный СООН-конец |
сложный гликопротеин ~ 67 000 дальтон (агд) ~ 75 000 дальтон (сув) 450 аминокислот (сод) 461 аминокислота (сод) 7 мембраносвязанных доменов, внеклеточный NН2-конец, внутриклеточный СООН-конец |
В сердечно-сосудистой системе найдены а-АР обоих типов. Находящиеся в артериях и венах а1 и а2-АР вызывают сокращение сосудов. В большинстве случаев в артериальных гладкомышечных клетках постсинаптические а1АР расположены на постсинаптической мембране, а2-АР — внесинаптически, т. е. в областях, непосредственно не примыкающих к адренергическому синапсу.
Высказывается предположение, что а1-AP реагируют на норадреналин, высвобождающийся из адренергических нервных окончаний, а внесинаптически расположенные a1-AP взаимодействуют с катехоламинами, циркулирующими в кровеносном русле. При гипертонической болезни происходит длительная активация аг-АР, приводящая к увеличению сосудистого сопротивления.
Значительное число постсинаптических а1АР обнаружено в ткани сердца; при их возбуждении наблюдается усиление силы и частоты сердечных сокращений. Помимо сердечно-сосудистой системы а1АР расположены и в ряде других органов и тканей организма, где их возбуждение приводит к усилению сокращений гладких мышц и увеличению секреции. А1АР вызывают сокращение капсулы селезенки, мигательной перепонки, пиломоторов, семявыносящего протока, семенных пузырьков, матки, дистальных отделов дыхательных путей легких, сфинктеров желудка, кишечника, мочевого пузыря. Возбуждение а1АР кишечника вызывает его расслабление. В печени под влиянием а1АР активируется фермент гликогенфосфорилаза, усиливается гликогенолиз. Под влиянием а1АР, находящихся в бурой жировой ткани, усиливается липолиз. При возбуждении а1АР в почках усиливается глюконеогенез.
в организме а2-АР бывают двух видов: пре- и постсинаптические. Пресинаптические а2-АР, расположенные по ходу холинергических нервов, иннервирующих ЖКТ, вызывают задержку выделения АХ, что приводит к расслаблению и угнетению секреторной функции ЖКТ. а2-АР, находящиеся в жировых клетках, угнетают липолиз, уменьшают в β-клетках поджелудочной железы высвобождение инсулина (последнее может служить основанием для использования а2-адреноблокаторов в антидиабетической терапии). Активация а2-АР циркулирующих в крови тромбоцитов вызывает их агрегацию. В различных областях ЦНС присутствуют ар и а2-АР, функции которых не выяснены.
Центральные АР а2-подтипа являются мишенями центрально действующих антигипертензивных ЛС: клонидина, гуанфацина и а-метилдофа (действующий через а-метилнорадреналин). В большом количестве а2-АР локализованы в понтомедуллярной области, в которой наблюдается высокая плотность (нор)адренергических синапсов. Основными ядрами этой области являются: вазомоторный центр, ядра солитарного тракта и блуждающего нерва. а2-АР присутствуют во всех трех ядрах. Стимуляция этих АР на постсинаптической мембране тормозных нейронов липофильными а2-агонистами, такими как клонидин или гуанфацин, снижает АД и частоту сердечных сокращений.
При действии на пресинаптические а2-АР агонистов происходит задержка выделения медиаторов ЦНС, в частности таких, как 5-гидрокситриптамин, АХ и дофамин. Контроль а2-АР за выделением нескольких медиаторов объясняет разнообразие изменений в ЦНС под влиянием агонистов а2-АР. Активация а2-АР может быть причиной развития седативного эффекта, аналгезии, брадикардии, гипотензии и ряда других явлений.
Молекулярная структура а-АР
Обработка рецепторных белков гликопротеин-специфичными ферментами, например эндогликозидазами, показала, что а-АР являются сложными гликопротеинами, включающими в свой состав различные углеводные остатки, присоединенные к аспарагиновым остаткам аминокислот. Гликозилирование а1- и а2-АР обусловливает существование различных подтипов АР.
Кажущаяся мол. м. очищенного белкового рецептора составляет около 80 ООО дальтон для арАР и 70 ООО дальтон для аг-АР. Молекула как а1АР, так и а2-АР содержит по семь мембраносвязанных доменов и внеклеточно расположенный NН2-конец, три внутри- и три внеклеточные петли и внутриклеточный СООН-конец. Внеклеточно расположенный NН2-конец содержит аспарагиновые остатки, которые являются местами гликозилирования, а третья внутриклеточная петля и СООН-концевая область содержат участки для фосфорилирования.
а1- и а2-АР являются представителями большого семейства рецепторов ПМ клеток. Это семейство, помимо а1- и а2-АР, включает также β1- и β2-АР, пять типов М-хо-линорецепторов, два подтипа серотониновых рецепторов, рецептор к субстанции К, ангиотензиновый рецептор, фоторецепторы зрения родопсин и опсин в палочках и колбочках, цАМФ-рецептор в плесневых грибах и рецептор к фактору слияния дрожжей. По своей структуре рецепторы этого семейства имеют большое сходство и запускают клеточную реакцию с помощью нуклеотидсвязывающих белков (G-белков).
Такие эффекторные системы включают в себя G-белки разного типа (Gs, Gj — стимулирующие и ингибирующие гуанинсвязывающие белки; Gx — неиденгифицированный белок, регулирующий активность фосфолипазы С или других эффекторов), ферменты аденилатциклазу и фосфолипазу, ионные каналы (калиевый, кальциевый каналы и др., Na+/H+—обменный механизм).
В развитии клеточной реакции в ответ на возбуждение а1-АР могут участвовать и другие механизмы, в частности, активация: 1) фосфолипазы Аг, которая освобождает арахидоновую кислоту — предшественника простагландинов, тромбоксанов, лейкотриенов и липоксинов из фосфолипидов мембран; 2) фосфолипазы С, вызывающей гидролиз фосфатидилхолина до фосфата холина и диацилглицерина с последующим усилением входа Са2+ в клетку через кальциевые каналы; 3) фосфолипазы Д, образующей фосфатидную кислоту, облегчающую вход Са2+ внутрь клетки, и, возможно, активация 4) фосфодиэстеразы, понижающей уровень цАМФ.
Разные подтипы а1-АР действуют, по-видимому, через разные механизмы. В частности, а1А-АР усиливают вход в клетку внеклеточного Са2+, a a1B-AP — опосредуемое IP3 высвобождение внутриклеточного Са2+.
Таким образом, в функционировании а1АР принимают участие несколько эффекторных систем и соответственно несколько G-белков.
Развитие а2-адренергической реакции опосредуется через угнетение аденилатциклазы и снижение уровня цАМФ, изменение содержания внутриклеточного Са2+ и К+ и независимой от цАМФ активации Nа+/Н+-обмена.
β-Адренорецепторы
Таблица 11. Агонисты и антагонисты β-АР
Вещество |
Рецепторы |
Агонисты |
|
Норадреналин (норэпинефрин) |
βl+a1+ a2 |
Адреналин (эпинефрин) |
βl+β2+ a1+ a2 |
Добутамин |
Β1 > β2 + a1 |
Изадрин (изопреналин, изопротеренол) |
β l + β2 |
Орципреналин (метопротеренол) |
β 1 + β 2 |
Фенотерол |
β 2 » β1 |
Пирбугерол |
β 2 » β1 |
Римитерол |
β 2 » β1 |
Ритодрин |
β 2 » β1 |
Сальбутамол |
β 2 » β1 |
Тербуталин |
β 2 » β1 |
Антагонисты |
|
Пропранолол |
β 1+ β2 |
Алпренолол |
β 1+ β2 |
Пиндолол |
P1+P2 |
Окспренолол |
P1+P2 |
Тимолол |
P1+P2 |
Соталол |
P1+P2 |
Практолол |
β 1 » β 2 |
Атенолол |
β 1 » β2 |
Метопролол |
β 1 » β2 |
Ацебутолол |
β 1 » β2 |
ICI 118,551 |
β 2 » β1 |
Бутоксамин |
β 1 » β2 |
Адреналин в одинаковой степени активирует как а1-, а2-, так и β1 и β2-АР. Медиатор адренергических нервов норадреналин также возбуждает а1, а2- и β1-АР. Возбуждают β1 и β2-АР такие соединения, как изадрин (изопреналин) и орципреналин (метопротеренол). Существует сравнительно мало веществ, избирательно влияющих на Pi-АР; наиболее известен из них добутамин.
Для β2АР специфическими агонистами являются сальбутамол, фенотерол и другие.
Малоизбирательными антагонистами β-АР являются пропранолол (обзидан, анаприлин), алпренолол, пиндолол и др.
Специфическими блокаторами β1-АР являются практолол, атенолол, метопролол и многие другие. В сравнении с блокаторами β1-АР число соединений, избирательно блокирующих β2-АР, невелико; наиболее известные из них — бутоксамин и вещество ICI
Локализация и функции β-АР в организме
Подтипы β-АР различаются как по локализации в пределах синапсов, так и по распределению в организме. Как и для а-АР, различают центральные и периферические β -АР. В отличие от а-АР, по отношению к синапсу β-АР в основном расположены постсинаптически (β1-AP) или внесинаптически (β2-АР). В периферической части нервной системы найдены пресинаптические β -АР (по-видимому, β2-АР подтипа). По принципу положительной обратной связи их возбуждение приводит к высвобождению норадреналина, а блокада пресинаптического β2-АР соответствующими антагонистами тормозит его выделение в синаптическую щель. В ЦНС пресинаптические АР пока не выявлены.
Так же, как и для а-АР, широкая распространенность и гетерогенность β-АР в организме обусловливает многообразие биологических эффектов, возникающих при их возбуждении или блокаде фармакологическими средствами.
Топография β-АР и их подтипов представлена в табл. 7. Они встречаются практически во всех тканях и органах организма. При этом в клетках одного типа могут быть βАР различных подтипов. В разных отделах сердца преобладают β1АР, возбуждение которых приводит к увеличению силы и частоты сердечных сокращений, проводимости,, повышению возбудимости и автоматизма, активации гликоге-нолиза, расширению коронарных сосудов. Активация β1АР, находящихся в ЖКТ, вызывает его расслабление; в белой и бурой жировой ткани они усиливают липолиз; в почках обусловливают выброс ренина.
β2-АР в сравнении с β1-АР являются более распространенными в организме. В силу своей внесинаптической локализации они реагируют в первую очередь на катехоламины, циркулирующие в крови.
β2-АР находятся в легких, кровеносных сосудах, матке, а также в сердце, жировой ткани, печени, скелетных мышцах, островковой ткани поджелудочной железы, щитовидной железе, семенниках, слезных железах. Их возбуждение приводит к расширению бронхов и сосудов, расслаблению матки, увеличению секреции ренина, инсулина и йодсодержащих гормонов, активации гликогенолиза в скелетных мышцах и печени, липолиза в жировой ткани, стимуляции стероидогенеза в семенниках.
Пресинаптические β2-АР расположены на окончаниях периферических симпатических и холинергических нервов. При их активации увеличивается высвобождение норадреналина и АХ.
Молекулярная структура β-АР
По химическому строению β-АР являются гликопротеинами. Как и в случае а-АР, белковая цепь β-АР состоит из семи гидрофобных доменов, каждый из которых образует трансмембранную спираль, с находящимися между ними гидрофильными петлями, расположенными попеременно по обе стороны клеточной мембраны. Концевая область белковой молекулы АР, содержащая аминогруппу, расположена внеклеточно, а содержащая карбоксильную группу — внутриклеточно. Трансмембранные гидрофобные домены примерно одинаковы по размерам и содержат по 20-25 аминокислотных остатков; гидрофильные домены (петли) АР более вариабельны по длине. Будучи гликопротеином, АР содержит в областях внеклеточного NН2-конца гликозилированные участки (в количестве 1-3). Значение гликозилирования для функции АР до сих пор не выяснено./Связь с ПМ/ Известно, что гликозилирование не влияет на взаимодействие АР с лигандом или G-белками.
Аминокислотные остатки в жирно обведенных кружочках, как предполагают, участвуют в связывании лиганда. Области третьей внутриклеточной петли участвуют в связывании G-белков, а область, отмеченная пунктиром, необходима для агонистопосредуемого секвестрирования. замена ASP-79 во втором домене приводит к 10-кратному уменьшению сродства АР к агонистам, но не влияет на связывание ангагонистов. В противоположность этой закономерности, замена ASP-113 в третьем домене изменяет связывание и агонистов, и антагонистов. Поскольку адренергические лиганды, как правило, — протони-рованные амины, предполагают, что участок АР, связывающий лиганд, должен содержать кислую аминокислотную боковую цепь, способную взаимодействовать с аминогруппой лиганда. Такой аминокислотой, по-видимому, является ASP-113, отрицательно заряженный остаток которой в ходе ионного взаимодействия может связывать протонированную аминогруппу адренергического агониста или антагониста.
Изучение структуры и активности адренергических лигандов выявило и другие структурные особенности лигандов, необходимые для взаимодействия с АР. В частности, для адренергических агонистов необходимо наличие катехолового кольца, которое образует водородные связи и вступает в гидрофобные взаимодействия с аминокислотными боковыми цепями в лигандсвязывающей зоне АР. В его формировании участвуют несколько боковых цепей аминокислот из различных лежащих в гидрофобной части АР доменов внутри фосфолипидного бислоя клеточной мембраны.
В ходе ионного взаимодействия протонированная аминогруппа лиганда связывается с карбоксилом боковой цепи аминокислоты ASP-113, несущей отрицательный заряд и находящейся в 3-й трансмембранной спирали гидрофобного домена.
Гидроксилы катехолового участка молекулы лиганда образуют водородные связи с SER-остатками, находящимися в 5-й трансмембранной спирали. Ароматическая часть молекул лиганда может вступать в гидрофобные взаимодействия с аминокислотными остатками в 6 спирали АР. Нахождение лигандсвязывающего участка АР внутри фосфоли-пидного бислоя клеточной мембраны объясняет, почему гидрофобные Р-адреноблокаторы связываются более прочно (в 104 раз), чем эндогенные гидрофильные катехоламины.
Другим функционально значимым центром р-АР является область взаимодействия с G-белками, связанными с аденилатциклазой и регулирующими ее активность. Связывание АР с G-белками происходит со стороны внутренней поверхности ПМ в месте нахождения 3-й внутриклеточной петли АР (рис. 14).
Для связывания с G-белками и активации аденилатциклазы абсолютно необходима область петли, состоящая из восьми аминокислот (остатки 222-229) и образующая связь между карбоксильным концом 5-й трансмембранной спирали и 3-й внутриклеточной петлей Взаимодействие активированного адренергическими лигандами рецептора с G-белком в составе комплекса G-белок—аденилатциклаза (G-циклазный комплекс) активирует фермент с последующим изменением клеточного метаболизма. Последовательность событий при этом выглядит следующим образом (рис. 16).
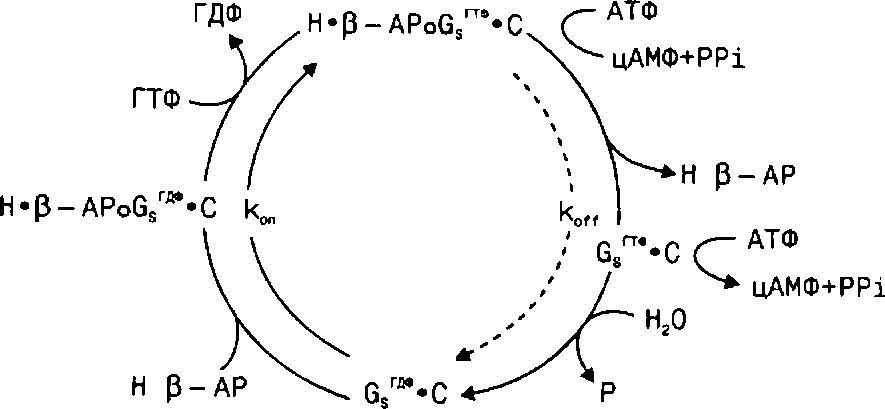
Рис. 16. Взаимодействие адренергических агонистов
с аденилатциклазным комплексом р-АР. Обозначения: Н - адренергический агонист, Gs-белок, стимулирующий аденилатциклазу, связывающий гуаниновые нуклеотиды, С - аденилатциклаза, прочность связи - ° < х < •.
При связывании адренергических агонистов с р-АР последний активируется практически мгновенно. Длительное взаимодействие агониста с р-АР приводит к прогрессирующему уменьшению способности р-АР реагировать на связанный агонист. Это явление носит название десенситизации АР и на молекулярном уровне заключается в отщеплении АР от комплекса G-белок—аденилатциклаза.
Процесс десенситизации АР развивается в ходе непосредственного взаимодействия с агонистом и обусловлен фосфорилированием рецептора. Рецепторы, связывающие G-белки, содержат богатые Ser/Thr области на СООН-конце и/или в 3-й внутриклеточной петле, которые могут фосфорилироваться под влиянием фермента киназы р-АР. Фос-форилированный АР становится функционально не зависимым от аденилатциклазы и секвестрируется в специальные компартменты в мембране. Десенситизированный АР удаляется с поверхности клетки в пока не идентифицированные внутриклеточные компартменты, не доступные внеклеточному агонисту. В дальнейшем АР может возвратиться в мембрану или транспортироваться в лизосомы для разрушения. Ресенситизация АР путем его дефосфорилирования осуществляется специфической фосфатазой.
