
- •Обмен кальциевый внутриклеточный: влияние активаторов аденилатциклазы
- •Содержание
- •Структура и свойства
- •Связь с мембраной
- •Стуктурно-функциональная организация g-белков
- •Классификация по чувствительности к токеинам
- •Сопряжение с эффекторными системами
- •Регуляция активности g-белков
- •Аденилатциклаза
- •Фосфолипазы
- •Протеинкиназы
- •Фосфодиэстеразы
- •Аденилатциклазная система
- •Влияние бактериальных токсинов на активность аденилатциклазы (адф-рибозилирование g-белков)
- •Инозитолфосфатная система
- •Участие белка кальмодулина в инозитолфосфатной передаче сигнала
- •Саморегуляция системы
- •Β и γ субъединицы: общая характеристика
- •Литература
Аденилатциклаза цАМФ G-белки
Обмен кальциевый внутриклеточный: влияние активаторов аденилатциклазы
Рассмотрим в общих чертах влияние на внутриклеточный кальциевый обмен агонистов, рецепторы которых сопряжены с аденилатциклазой. Как известно, аденилатциклаза и система обмена фосфоинозитидов и Са## - это две основные сигнальные системы, имеющиеся во всех клетках животных. Их функционирование взаимосвязано.Взаимодействие кальциевой и циклазной систем проявляется как на уровне регуляции или активности друг друга, так и посредством скоординированного влияния на биохимические процессы, происходящие в клетке ( Авдонин и др., 1986 ; Houslay, 1991 ). В табл. 11 представлены данные о влиянии активаторов аденилатциклазы на рецепторзависимое увеличение Ca и на сопряженные с обменом кальция процессы.
Как видно из приведенных в табл. данных, исходя из характера гормональной регуляции среди клеток могут быть выделены два типа. В одном типе клеток агонисты, активирующие аденилатциклазу , подавляют Са-зависимые процессы и в большинстве, если не во всех случаях ингибируют подъем Ca. К этой группе относятся клетки крови: тромбоциты , лимфоциты , лейкоциты , кроме того астроциты , и по крайней мере некоторые виды гладкомышечных клеток .
Представителями клеток с противоположным характером гормональной регуляции являются гепатоциты , секреторные клетки гипофиза , околоушной железы , надпочечников , некоторые другие, в которых агонисты, стимулирующие аденилатциклазу, могут либо активировать сами, либо усиливать Са-зависимые реакции клетки. Во многих случаях такого рода синергизм связан с тем, что цАМФ потенциирует рецепторзависимое увеличение Ca.
Таблица 11. Влияние активаторов аденилатциклазы и цАМФ на Ca
Агонист |
Тип клеток или тканей |
Эффект |
Литературный источник |
Серотонин |
Клетки слюнной железы |
Активирует вход Ca2+ |
Berridge, Rupp 1979 Rupp, Berridge 1981 |
Гистамин |
Flowfly Callifora erythrocephala |
Увеличивает частоту кальциевых осцилляций за счет подъема ц-АМФ |
Burgess ea 1986 |
Изопротеренол |
Гепатоциты морской свинки |
Увеличивает выход 86Rb и 45 Ca, вызванный AT II |
Burgess ea 1986 |
Форсколин, гистамин (H2 -рецепторы) |
Париетальные клетки желудка |
Повышают [Ca2+]цит |
Chew 1986 |
Глюкагон |
Гепатоциты |
Повышает [Ca2+]цит |
Charest ea 1983 |
Адреналин |
Тромбоциты |
Увеличивает вызванный агонистами подъем [Ca2+]цит |
Herpecky ea 1989 |
Лютеинизирующий гормон |
Orarian granulosa |
Активирует синтез прогестерона, ФИ-обмен |
Sadighian ea 1989 |
Дибутирилц-АМФ |
То же |
Активирует синтез прогестерона |
Sadighian ea 1989 |
Изопротеренол |
Эпителий дыхательных путей |
Увеличивает [Ca2+]цит, но не активирует ФИ-обмен |
McCann ea 1989 |
Кортикотропин- рилизинг фактор |
Клетки передней доли гипофиза |
Активирует секрецию АКТГ, АЦ, повышает [Ca2+]цит |
King, Baetschi 1990 |
Arg-вазопрессин |
То же |
Повышает [Ca2+]цит |
- |
Форсколин |
Хромаффинные клетки надпочечников |
Потенциирует КАМ секрецию, вызванную никотином и мускарином, но не увеличивает захват 45Са |
Malhotra ea 1989 |
ВИП |
То же |
Активирует секрецию КАМ, стимулирует ФИ-обмен и увеличение цАМФ |
Malhotra ea 1989 |
Глюкагон, форсколин, дибутирил цАМФ |
Гепатоциты крысы |
Увеличивает в 2-3 раза скорость входа Mn2+ |
Kass ea 1990 |
ПГЕ2, форсколин, 8-(4-хлорофенил-тио) -цАМФ |
Т-лимфациты человека |
- |
Kelley ea - |
Нейропептид Y |
Гладкомышечные клетки аорты |
Потенциирует вызванные AT II сокращение и активацию ФИ-обмена |
Lobaugh, Black-Shear 1990 |
Изопротеренол |
Гроздевидные (ацинарные) клетки околоушных желез |
Потенциирует секрецию амилазы и подъем [Са2+] цит, вызванный карбохолином или норадреналином (через альфарецепторы) |
McKinney ea 1989 |
Простагландины E1, D2, I2, форсколин, дибутирил-цАМФ теофилин, ИБМК |
Тромбоциты |
Подавляют подъем [Са2+] цит, вызванный агонистами |
Rink, Smith 1983 Feinstein ea 1983 |
Форсколин |
Лимфоциты |
Подавляет подъем [Са2+] цит, вызванный конкавалином |
Мошковский, др 1990 |
Паратироидный гормон |
ГМК аорты крысы |
Частично ингибирует вызванное норадреналином сокращение и вход Са2+ |
Schleiffer ea 1989 |
Паратироидный гормон |
ГМК дыхательных путей |
цАМФ ингибирует вызванный карбохолином подъем [Са2+] цит, ФИ-обмен |
Rasmussen ea 1990 |
Изопротеренол, форсколин |
Гладкая мышца радужной оболочки глаза |
Расслабление, ингибирование синтеза ИнФ3 |
Tachado ea 1989 |
Аналог простациклинаберапрост, простагландины Е2 и I2 |
Полиморфоядерные лейкоциты крыс |
Подавляют вызванные ФМЛФ повышение [Са2+]цит активацию ФИ обмена и хемотаксис |
Kainoh ea 1990 |
Изопротеренол, дибутирил-цАМФ ингибиторы ПКА |
Астроциты |
Ингибируют вызванную гистамином активацию ФИ обмена |
Robertson ea 1990 |
АДЕНОЗИНМОНОФОСФАТ
ЦИКЛИЧЕСКИЙ
(аденозин-3,5-циклофосфат; 3,5-АМФ; цАМФ),
мол. м. 329,22; бесцв. кристаллы;![]() — 51°; соли Na, К и аммония хорошо раств.
в воде, соли Ag и двухвалентных металлов
в воде практически не растворяются.
— 51°; соли Na, К и аммония хорошо раств.
в воде, соли Ag и двухвалентных металлов
в воде практически не растворяются.
Конфигурация
остатка рибозы в цАМФ-С3-эндо-С4-экзо
. Циклофосфатное
кольцо, конденсированное с рибозным
циклом, имеет конформацию кресла.
Кристаллич. ячейка состоит из двух
молекул, в одной из к-рых аденпновое
основание расположено в син-, а в другой-в
анти-конформации относительно рибозного
кольца. Последняя конформация характерна
также для молекул в р-ре.
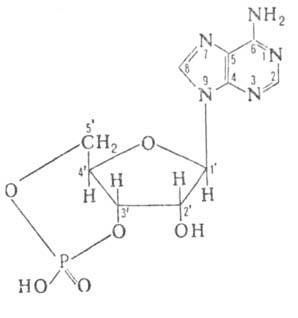
цАМФ-вторичный мессенджер, т.е. осуществляет ф-ции внутриклеточного посредника в действии первичных мессенджеров-ряда гормонов и медиаторов (передатчиков) нервного возбуждения. Участвует также в регуляции обмена углеводов и липидов, клеточного роста, мембранного транспорта и др. В бактериальных клетках цАМФ, взаимодействуя со специфич. рецепторным белком, вызывает в нем конформационные изменения, в результате чего белок приобретает способность связываться с клеточной ДНК и регулировать активность генов. В клетках высших организмов цАМФ активирует фермент протеинкиназу, к-рый катализирует перенос остатка фосфорной к-ты с АТФ на белок. Активация заключается в связывании цАМФ с регуляторной субъединицей фермента, в результате чего освобождается активная каталитич. субъединица, к-рая и осуществляет р-цию. Протеинкиназа может катализировать фосфорилирование нек-рых ферментов, а также ряда регуляторных и структурных белков, что приводит к изменению их св-в. Так, фермент киназа фосфорилазы b фосфорилируется с образованием активной формы, к-рая сама в свою очередь катализирует фосфорилирование др. фермента-фосфорилазы b. Последняя ускоряет распад гликогена в организме.
цАМФ оказывает влияние и на дефосфорилирование белков, к-рое осуществляется под действием протеинфосфатаз. Так, Протеинкиназа фосфорилирует один из белков, в результате чего он приобретает св-ва ингибировать фосфата-зу1-фермент, катализирующий дефосфорилирование. Метаболизм цАМФ осуществляют два фермента -аденил-атциклаза, катализирующая синтез цАМФ из АТФ, и фосфодиэстераза цАМФ, к-рая катализирует гидролиз цАМФ по З-фосфоэфирной связи с образованием 5-аденозинмонофосфата.
А. ц. открыт Э. Сазерлендом в 1957. Его получают циклизацией 5-аденозинмонофосфата под действием N, N-дициклогексилкарбодиимида.
АДЕНИЛАТЦИКЛАЗА
(АТФ-, или АТР-пирофосфатлиаза
циклизирующая), фермент класса лиаз,
катализирующий в присут. Mg2+
гидролиз аденозинтрифосфата (АТФ) с
образованием пирофосфорной к-ты Н4Р2О7
и аденозин-монофосфата
циклического (цАМФ).
А. обнаружена практически во всех тканях
животных, а также у бактерий. Предполагается
существование этого фермента у растений.
В клетках животных он локализован в
плазматич. мембранах, у бактерий-в
мембранах и цитоплазме. Мол. масса А. у
большинства организмов неизвестна;
предполагают, что она колеблется в
пределах 150-600 тыс. Из ряда бактерий А.
выделена в индивидуальном виде; мол.
масса каталитич. субъединиц в этих
А.-30-40 тыс.

Схема активации аденилатциклазы; GTP-гуанозинтрифосфат.
Функционирует А. в составе сложного комплекса, состоящего из гормонального рецептора (R), расположенного на внеш. стороне клеточной мембраны, внутримембранного регуляторного белка (G), в состав к-рого входит остаток гуанозиндифосфата (GDP), и каталитич. субъединицы (CS). Активация А. осуществляется в результате действия нек-рых гормонов, напр. глюкагона, тиреотропного, адренокортикотропного и лютеинизирующего гормонов, простагландинов группы Е. Гормон, взаимодействуя с R, образует гормон-рецепторный комплекс HorR, к-рый, реагируя с G-GDP (см. схему), вызывает каскад р-ций. Непосредственно катализирует превращение АТФ в цАМФ комплекс CS * [G-GTP], к-рый в клетке быстро распадается на CS и G-GDP.
В клетке существуют также рецепторы (напр., ацетилхолина, чувствительного к мускарину), к-рые тормозят синтез цАМФ. Эти рецепторы функционируют в комплексе с регуляторными G-белками, отличными от тех, к-рые участвуют в активации фермента. Благодаря механизму активации и ингибирования А. нейроэндокринная система может регулировать концентрацию цАМФ в клетке.
Лит. см. при ст. Аденозинмонофосфат циклический
цАМФ был открыт в конце 50-х годов прошлого века как вторичный посредник, передающий сигналы в клетку от множества гормонов, нейротрансмиттеров, простагландинов, ряда других субстанций, которые активируют аденилатциклазу. До недавнего времени считалось, что универсальным механизмом действия цАМФ является активация протеинкиназы А. В 1998 г. были обнаружены новые внутриклеточные мишени цАМФ – белки Epac1 и Epac2 (Exchange Proteins Activated by cAMP). Они широко распространены в организме и по крайней мере один из этих белков, Epac1, выявлен во всех исследованных тканях. Связывая цАМФ, белки Epac взаимодействуют с низкомолекулярными G-белками Rap1A/2B и стимулируют замещение ГДФ на ГТФ в их регуляторном центре, поэтому их обозначают также как cAMP-GEF (guanine nucleotide exchange factor). Белки Rap активируют протеинкиназу B-Raf, которая, в свою очередь, активирует протеинкиназный каскад MEK/Erk. Несколько позднее было установлено, что помимо Rap, белки Epac активируют специфичную к фосфоинозитидам фосфолипазу С-, KATP-каналы, влияют на функционирование хлорных каналов (Holz, 2006). В кардиомиоцитах мыши выявлен макромолекулярный комплекс Epac1 с рианодиновыми рецепторами, протеинкиназой А и фосфодиэстеразой цАМФ (Dodge-Kafka et al., 2005).
Изучение роли белков Epac в регуляции цАМФ-зависимых физиологических процессов находится на начальной стадии. Показано, что, наряду с протеинкиназой А, белки Epac активируют секрецию, влияют на межклеточные взаимодействия, процессы дифференцировки и апоптоза, принимают участие в регуляции ионных каналов и передачи сигнала в синапсе. (Holz, 2006). цАМФ играет ключевую роль в регуляции работы сердца и всей сердечно-сосудистой системы, вызывая расслабление кровеносных сосудов (Kotlikoff, 1996) и стимуляцию сократимости сердца (Kammerer, 2003). Доказано, что в реализации этих эффектов цАМФ участвует протеинкиназа А, однако роль белков Epac в проявлении действия цАМФ на сосуды и сердце не исследовалась.
Ингибирование фосфодиэстеразы. Аденозин 3’-5’-цикломонофосфат (цАМФ) и гуанозин 3’-5’-цикломонофосфат (цГМФ) играют важную роль в регуляции тонуса гладкомышечных клеток, и увеличение концентрации этих веществ причинно связано с релаксацией мускулатуры.
Внутриклеточная концентрация циклических нуклеотидов определяется их относительной скоростью образования посредством агонист-индуцируемой стимуляции аденилатциклазы (агонист - норадренолин) и гуанилатциклазы (агонист - ацетилхолин), а также скоростью их гидролиза фосфодиэстеразными ферментами клеток (ФДЭ).
ЦАМФ и цГМФ синтезируются из соответствующих нуклеозидтрифосфатов с помощью мембранносвязанных ферментов аденилатциклазы и гуанилатциклазы, соответственно. цАМФ и цГМФ инактивируются ФДЭ до неактивных нециклических рибозофосфатов.
Аденилатциклазная система универсальна; цАМФ и цГМФ являются важными внутриклеточными вторичными мессенжерами в гладкомышечных клетках различных органов (гладкая мускулатура ЖКТ, трахеи, бронхов, матки, мочеточников, сосудов, миокарда), а также клетках других тканей (тромбоциты, лимфоциты, секреторные клетки, ЦНС и т.д.); она обеспечивает различные функции (тонус мышц, секреция, агрегация и т.д.). Значительная вариация функций аденилатциклазной системы обеспечивается существованием многочисленных изоферментов ФДЭ в различных видах тканей (тканеспецифические и видоспецифические). Изоферменты ФДЭ отличаются по их физическим и кинетическим характеристикам, субстратной (цАМФ или цГМФ) специфичности, чувствительности к эндогенным активаторам и ингибиторам, чувствительности к фосфорилированию с помощью протеинкиназ, распределению в тканях и локализации в клетке. Так, различия во внутриклеточном распределении изоферментов ФДЭ является важным фактором, определяющим их индивидуальную регуляторную роль. По данным серии экспериментальных исследований установлено около 7 различных семейств ФДЭ: Ca2+-кальмодулин-зависимые (ФДЭ I), цГМФ-стимулируемые (ФДЭ II), ц-ГМФ-ингибируемые (ФДЭ III), цАМФ-специфические (ФДЭ IV), цГМФ-специфические (ФДЭ V), фотоспецифические (ФДЭ VI), высокоаффинные (устойчивые) (ФДЭ VII).
Таким образом, ФДЭ играет основную роль в регуляции тонуса гладкой мускулатуры и представляет собой удобную клеточную мишень для разработки лекарственных препаратов.
ФДЭ, выделенные из различных тканей, содержат все изоферменты, но в разных количествах. В экспериментальных исследованиях были установлены наиболее значимые типы ФДЭ в разных тканях и созданы селективные ингибиторы ФДЭ. Так, известны селективный ингибитор ФДЭ III милринон, селективный ингибитор ФДЭ IV ролипрам, селективный ингибитор ФДЭ V запринаст. Милринон является некатехоламиновым инотропным средством для кардиомиоцитов и вызывает релаксацию гладкой мускулатуры сосудов; ролипрам, по первоначальным данным, являлся ингибитором ФДЭ мозга, а затем его эффект был показан на ФДЭ IV мускулатуры дыхательных путей, клетках печени, лимфоцитов.
Результаты исследований показали, гладкая мускулатура толстого кишечника содержит почти все изоформы ФДЭ, и не только неселективные ингибиторы, но и селективные ингибиторы ФДЭ III, IV, V типов вызывали расслабление. Ролипрам, прототип селективного ингибитора ФДЭ IV, обладает наиболее выраженным спазмолитическим эффектом, как для продольной, так и поперечной мускулатуры кишечника. Эти результаты доказали, что ФДЭ IV типа функционально наиболее важна в регуляции контрактильной активности кишечника, и что селективный ингибитор ФДЭ IV может быть использован в лечении гипермоторных состояний и различных заболеваний, связанных со спастическими состояниями ЖКТ.
В гладкомышечных клетках мочевыводящих путей обнаружено существование, по крайней мере, трех различных изоформ (I, II, IV), преобладает ФДЭ IV (6).
Миометрий при беременности содержит большие дозы ФДЭ IV (50%) и ФДЭ III (10%). ФДЭ IV содержится как в начальном периоде беременности, так и в последнем триместре. Предполагается, что ФДЭ IV в конце беременности способствует (через изменение уровня цАМФ) подготовке миометрия к родами контролю за сократительной активностью матки. Использования в опыте на изолированной матки, показали, что селективные ингибиторы ФДЭ IV могут снижать чувствительность органа к окситоцину и приводить к быстрому расслаблению матки после применения максимальной концентрации окситоцина, что может быть полезно при преждевременных родах.
G-белки и их функции
