
- •1 Предмет технической термодинамики. Параметры состояния рабочего тела. Уравнения состояния идеального газа. Термодинамический процесс.
- •2.Первый закон термодинамики. Работа, теплота, внутренняя энергия, энтальпия
- •3 Вывод 1закона через энтальпию, через энтропию
- •11.Анализ политропного процесса
- •12 Реальные газы. Фазовые переходы в координатах p-V, t-s,p-t. Работа и теплота фазового перехода.
- •13 Диаграмма h-s водяного пара. Определение работы, теплоты, внутренней энергии по диаграмме.
- •14. Круговые процессы. Второй закон термодинамики. Цикл Карно прямой и обратный.
- •15 Цикл теплосиловых установок. Координаты p-V,t-s. Вывод термического кпд. Цикл Тренклера.
- •16 Цикл дизеля
- •17 Цикл Отто
- •18. Цикл Ренкина
- •19 Цикл воздушной холодильной установки .
- •19 А цикл газотурбиной установки. Цикл гту с регенерацией теплоты.
- •20 Теплопроводность. Закон Фурье. Расчет плотности и мощности теплового потока для плоской и цилиндрической одно и многослойной стенки.
- •1). Теплопередача через плоскую стенку.
- •21 Конвективный теплообмен. 3-ий закон Ньютона-Рифмана. Определение коэффициента теплоотдачи и методика его решения. Критерии и подобия и китериальные уравнения.
- •22 Сложный теплообменю Коэффициент теплопередачи.
- •23 Теплообменные аппараты. Виды, расчет. Прямоток, противоток.
- •26 Диаграмма h-d влажного . Процесс сушки на диаграмме.
- •27 Цикл компресса. Работа при изотермическом, адиабатном, политропном сжатии. Предельная степень сжатия
- •28.Способы повышения кпд паросиловой установки. Цикл со вторичным перегревом пара. Парогазовый цикл.
- •29 Устройство современного котельного агрегата, котельной установки. Тепловой баланс котельного агрегата. Кпд брутто и нетто, определение расхода топлива на котел.
- •30 Системы отопления жилых помещений. Расчет и подбор приборов отопления.
3 Вывод 1закона через энтальпию, через энтропию
Энтальпия
Ранее
была приведена так называемая интегральная
форма записи первого закона (1), согласно
которой для произвольного количества
вещест![]()
Для
1 кг вещества:
![]()
Дифференциальная
форма записи уравнения первого закона
при анализе термодинамических процессов
часто оказывается более удобной.
Уравнение первого закона термодинамики
можно представить в другом виде. К
выражению
![]()
прибавим
и вычтем слагаемое Vdp:
![]() Последнее
слагаемое представляет собой элементарную
располагаемую работу. Функцию
Последнее
слагаемое представляет собой элементарную
располагаемую работу. Функцию
![]() измеряемую в Дж, в термодинамике
называют энтальпией. Энтальпия,
отнесенная к 1 кг
измеряемую в Дж, в термодинамике
называют энтальпией. Энтальпия,
отнесенная к 1 кг
![]() называется удельной энтальпией. Входящие
в выражение (19) величины u, p, υ являются
параметрами состояния, поэтому и сама
энтальпия также будет параметром
(функцией) состояния. Тогда аналитические
выражения для первого закона примут
вид:
называется удельной энтальпией. Входящие
в выражение (19) величины u, p, υ являются
параметрами состояния, поэтому и сама
энтальпия также будет параметром
(функцией) состояния. Тогда аналитические
выражения для первого закона примут
вид:
![]()
![]()
![]() Записывая последнее выражение для
изобарного процесса p=const, получаем:
Записывая последнее выражение для
изобарного процесса p=const, получаем:
![]() т.е. изменение энтальпии численно равно
количеству теплоты, подводимому к
системе в изобарном процессе. Тогда
можно записать:
т.е. изменение энтальпии численно равно
количеству теплоты, подводимому к
системе в изобарном процессе. Тогда
можно записать:
![]() В заключение следует отметить, что
общее уравнение первого закона
термодинамики
В заключение следует отметить, что
общее уравнение первого закона
термодинамики
![]()
Энтропия
Одним из функций состояния термодинамической системы является энтропия. Энтропией называется величина определяемая выражением:dS = dQ / T. [Дж/К] (3.1)или для удельной энтропии:ds = dq / T. [Дж/(кг·К)] (3.2)
Энтропия есть однозначная функция состояния тела, принимающая для каждого состояния вполне определенное значение. Она является экстенсивным (зависит от массы вещества) параметром состояния и в любом термодинамическом процессе полностью определяется начальным и конечным состоянием тела и не зависит от пути протекания процесса.
Энтропию можно определить как функцию основных параметров состояния:S = f1(P,V) ; S = f2(P,T) ; S = f3(V,T) ; (3.3)или для удельной энтропии:s = f1(P,υ) ; s = f2(P,T) ; S = f3(υ,T) ; (3.4)
Так как энтропия не зависит от вида процесса и определяется начальными и конечными состояниями рабочего тела, то находят только его изменение в данном процессе, которые можно найти по следующим уравнениям:
Ds = cv·ln(T2/T1) + R·ln(υ 2/υ 1) ; (3.5)
Ds = cp·ln(T2/T1) - R·ln(P2/P1) ; (3.6)
Ds = cv·ln(Р2/Р1) + cр·ln(υ 2/υ 1) . (3.7)
Если энтропия системы возрастает (Ds > 0), то системе подводится тепло.
Если энтропия системы уменьшается (Ds < 0), то системе отводится тепло.
Если энтропия системы не изменяется (Ds = 0, s = Const), то системе не подводится и не отводится тепло (адиабатный процесс).
5.Исследование изохорного процесса, изобарного, изотермического, адиабатного, политропного.
1). Изохорный процесс (Рис.4.1).
n = Const , n 2 = n 1. (4.10)
Уравнение состояния процесса:
P2 / P1 = T2 / T1. (4.11)
Так как υ 2 = υ 1, то l = 0 и уравнение 1-го закона т/д имеет вид:
q = Du = = сv·(t2 - t1); (4.12)

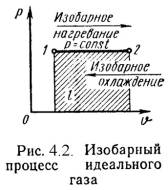
2). Изобарный процесс (Рис.4.2).
P = Const , P2 = P1
Уравнение состояния процесса:
n 2 /n 1 = T2 / T1 , (4.13)
Работа этого процесса:
l = P·(n 2 - n 1). (4.14)
Уравнение 1-го закона т/д имеет вид:
q = Du + l = ср·(t2 - t1); (4.15)
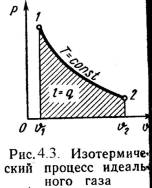
3). Изотермический процесс (Рис.4.3).
Т = Const , Т2 = Т1
Уравнение состояния:
P1 / P2 = n 2 / n 1 , (4.16)
Так как Т2 = Т1, то Du = 0 и уравнение 1-го закона т/д будет иметь вид:
q = l = R·T·ln(n 2/n 1), (4.17)
или q = l = R·T·ln(P1/P2), (4.18)
где R = Rh/ h – газовая постоянная [Дж/(кг·К)].
4). Адиабатный процесс (Рис.4.4).
В данном процессе не подводится и не отводится тепло, т.е. q =0.
Уравнение состояния:
P· nl = Const, (4.19)
где l = cp / cv – показатель адиабаты.
Уравнение 1-го закона т/д будет иметь вид:
l = -Du = = -сv·(t2 – t1) = сv·(t1 – t2), (4.20)
или
l = R·(T1 – T2) / (l -1); (4.21)
l = R·T1·[1 – (n 1/ n 2)l -1] /(l – 1); (4.22)
l = R·T2·[1 – (P2/P1) (l -1)/ l] /(l – 1). (4.23)
5)Политропный процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной. Предельными частными явлениями политропного процесса являются изотермический процесс и адиабатный процесс. В случае идеального газа изобарный процесс и изохорный процесс также являются политропическими.
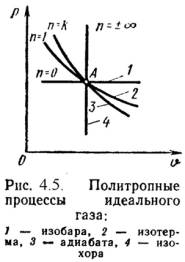
Для
идеального газа уравнение политропы
может быть записано в виде![]()
