
- •Лекция № 1 Тепловое излучение
- •1. Тепловое излучение и его характеристики
- •2. Абсолютно черное тело. Закон Кирхгофа. Законы Стефана – Больцмана и Вина
- •3. Формулы Вина, Рэлея – Джинса и Планка
- •4. Оптическая пирометрия
- •Лекция № 2 Фотоэлектрический эффект. Световое давление
- •1. Взаимодействие электромагнитного излучения с веществом
- •2. Основные законы фотоэффекта. Уравнение Эйнштейна для фотоэффекта. Красная граница
- •3. Корпускулярные свойства света. Фотоны. Энергия, импульс и масса фотона
- •4. Давление света
- •5. Эффект Комптона
- •6. Корпускулярно-волновой дуализм
- •Лекция № 3 Элементы квантовой механики
- •2. Границы изменения классической механики; соотношение неопределённостей Гейзенберга
- •3. Уравнение Шредингера для стационарного состояния; волновая функция и её статистический смысл
- •Лекция № 4 Атом водорода. Пространственное квантование
- •1 Зрит. Труба . Модель атома Резерфорда. Теория Бора
- •2. Квантовое число как результат решения уравнения Шредингера
- •3. Опыт Штерна и Герлаха. Спиновое квантовое число. Спин электрона
- •Глава IV, § 23 24;
- •Глава V, § 31, 33.
- •Лекция № 5 Атом и молекулы как квантовые системы
- •1. Принцип неразличимости тождественных частиц. Принцип Паули. Фермионы и Бозоны
- •2. Распределение электронов в атоме по состояниям. Формула Бальмера
- •3. Понятие об энергитических уровнях молекул, спектры молекул
- •Лекция № 6 Оптические квантовые генераторы
- •1. Поглощение, спонтанное и вынужденное излучения.
- •1. Поглощение, спонтанное и вынужденное излучения.
- •2. Принципы спонтанного равновесия
- •3. Принципы излучения действия лазера и особенности генерируемого им
- •Глава 43, § 433 434. Лекция № 7 Элементы квантовой статистики
- •1. Квантовая статистика. Фазовое пространство. Функция распределения
- •2. Статистика Бозе -Эйнштейна и Ферми-Дирака
- •3. Вырожденный электронный газ в металлах
- •4. Квантовая теория теплоемкости и электропроводности металлов
- •5. Сверхпроводимость. Эффект Джозефсона
- •Глава VI, § 48 49;
- •Глава VIII § 55 56.
- •Лекция № 8 Элементы физики твердого тела
- •1. Понятие о зонной теории твердых тел
- •2. Металлы, полупроводники и диэлектрики
- •3. Собственная проводимость проводников
- •4 . Примесная проводимость полупроводников
- •Лекция № 9 Элементы физики твердого тела
- •1. Контакт двух металлов
- •2. Термоэлектрические явления
- •3. Контакт металл – полупроводник
- •4. Контакт электронного и дырочного полупроводников (p–n – переход)
- •Лекция № 10 Элементы физики атомного ядра
- •1. Размер, состав и заряд атомного ядра. Массовое и зарядовое число
- •2. Дефект массы и энергия связи ядра
- •3. Спин ядра и его магнитный момент
- •4. Ядерные силы. Модели ядра
- •5. Радиоактивное излучение. Закон радиоактивного распада
- •Лекция № 11 Ядерные реакции и их основные типы
- •1. Ядерные реакции
- •2. Реакция деления ядра
- •3. Реакция синтеза атомных ядер
- •Лекция № 12 Применение квантовой механики
- •1. Уравнение Шредингера для свободной частицы, находящейся в одномерной прямоугольной “потенциальной яме”. Квантование энергии
- •2. Прохождение частиц сквозь потенциальный барьер. Туннельный эффект
- •3. Линейный, гармонический осциллятор
- •Поглощение, спонтанное и вынужденное излучения ...................................41
Лекция № 4 Атом водорода. Пространственное квантование
Модель атома Резерфорда. Теория Бора.
Квантовое число – как результат решения уравнения Шредингера.
Опыт Штерна и Герлаха. Спиновое квантовое число. Спин электрона.
1 Зрит. Труба . Модель атома Резерфорда. Теория Бора
В 1903 г. Резерфорд проводил исследование структуры атомов.
На пути узкого
пучка
![]() -
частиц располагалась тонкая металлическая
фольга из Au;
Ag;
Cu.
При прохождении через фольгу
-
частицы отклонялись на различные углы
-
частиц располагалась тонкая металлическая
фольга из Au;
Ag;
Cu.
При прохождении через фольгу
-
частицы отклонялись на различные углы
![]() .
Рассеянные
- частицы ударялись об экран, покрытый
сернистым цинком, и вызываемые ими
вспышки света наблюдались в зрительную
трубу (сцинтилляция). Труба и экран имеют
возможность вращаться вокруг оси,
проходящей через центр рассеивающей
фольги. Оказалось, что часть
- частиц рассеивается на очень большие
углы (почти 180o).
.
Рассеянные
- частицы ударялись об экран, покрытый
сернистым цинком, и вызываемые ими
вспышки света наблюдались в зрительную
трубу (сцинтилляция). Труба и экран имеют
возможность вращаться вокруг оси,
проходящей через центр рассеивающей
фольги. Оказалось, что часть
- частиц рассеивается на очень большие
углы (почти 180o).
Анализируя эти результаты, Резерфорд пришел к выводу, что сильное отклонение - частиц возможно лишь при условии, что внутри атома существует сильное электрическое поле, созданное зарядом с большой массой и сконцентрированный в малом объёме.
В 1911 году Резерфорд предложил ядерную модель атома.
Атом представляет собой электронейтральную систему зарядов, в центре расположено тяжёлое положительное ядро (зарядом +Ze), вокруг ядра по круговым орбитам с некоторой скоростью вращаются отрицательно заряженные электроны (полный заряд -Ze). При этом, почти вся масса сосредоточена в ядре, имеющем очень малые размеры по сравнению с размером атома. Размер атома определяется радиусом орбит электронов.
Анализ модели Резерфорда привёл к противоречию с точки зрения электродинамики:
1) Электрон, вращаясь
с
![]() м/с, движется
ускоренно (
м/с, движется
ускоренно (![]() )
и должен излучать энергию. Расчёты
показали, что за время
)
и должен излучать энергию. Расчёты
показали, что за время
![]() вся энергия, которой обладает электрон,
будет излучена, и он должен упасть на
ядро, а атом разрушиться. Однако на самом
деле атом устойчив.
вся энергия, которой обладает электрон,
будет излучена, и он должен упасть на
ядро, а атом разрушиться. Однако на самом
деле атом устойчив.
2) Вследствие излучения электроном энергии, он должен приближаться по спирали к ядру, при этом с периодической частотой излучая электромагнитную волну, и спектр излучения такого атома должен быть сплошным. Однако опыты показали, что спектр атома – линейчатый.
Из этих двух противоречий следует:
1. Либо знание классической физики неприемлемо к атому.
2. Либо атомы системы неустойчивы.
Эти противоречия устранил в 1912 году Нильс Бор. Он выдвинул два постулата:
1. Из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются в действительности только некоторые дискретные орбиты, удовлетворяющие определённым квантовым условиям. Электрон, находящийся на одной из этих орбит, несмотря на то, что он движется с ускорением, не излучает электромагнитных волн (света). Эти квантовые условия можно математически записать так:
![]() ,
,
где
![]() - скорость электрона по n-й
орбите; me
– масса электрона; rn
– радиус n-й орбиты
электрона;
- скорость электрона по n-й
орбите; me
– масса электрона; rn
– радиус n-й орбиты
электрона;
![]() - постоянная Планка; n –
целое число (1, 2, …, n).
- постоянная Планка; n –
целое число (1, 2, …, n).
2. Излучение
испускается или поглощается в виде
светового кванта энергии
![]() при переходе электрона из одного
стационарного (устойчивого) состояния
в другое. Величина светового кванта
равна разности энергии тех стационарных
состояний, между которыми совершается
квантовый скачок электрона:
при переходе электрона из одного
стационарного (устойчивого) состояния
в другое. Величина светового кванта
равна разности энергии тех стационарных
состояний, между которыми совершается
квантовый скачок электрона:
![]() .
.
Эти постулаты дали
возможность определить
![]() и
и
![]() ,
действующие на электрон. Рассмотрим
водородоподобный ион (ядро с зарядом
+Ze
и один электрон, движущийся вокруг него,
рис. 4.2)
,
действующие на электрон. Рассмотрим
водородоподобный ион (ядро с зарядом
+Ze
и один электрон, движущийся вокруг него,
рис. 4.2)
![]() ;
;
![]()
 ;
(1)
;
(1)
![]() ;
;
![]() ;
;
![]() ;
(2)
;
(2)
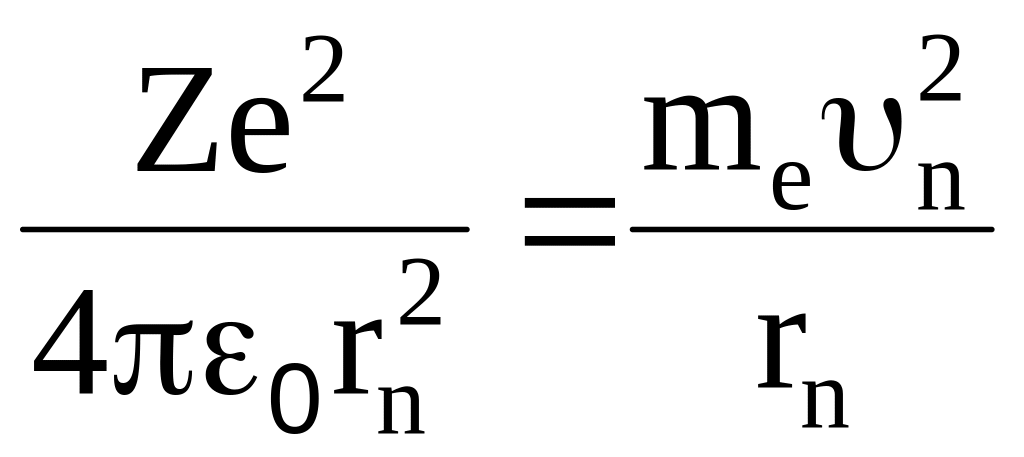 ;
;
 .
.
При этом радиус первой орбиты водородного атома (Z = 1, n = 1) называется боровским радиусом (символ r0 или r1), который равен
 .
.
![]() .
.
Н айдём
айдём
![]() - скорость на орбите, подставив значение
r
в формулу (1) постулата.
- скорость на орбите, подставив значение
r
в формулу (1) постулата.
![]() .
.
Найдём полную энергию:
![]() ,
,
![]() ,
,
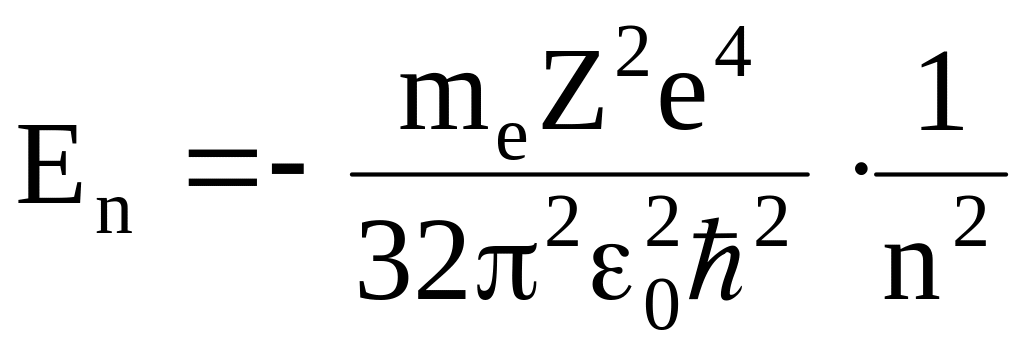 .
.
Полная энергия электрона в атоме квантуема (n = 1, 2, 3…) и отрицательна. Однако эта теория Бора пригодилась лишь для атома H2.
