
- •Коллоквиум. Образцы тестов. Вариант 1
- •Часть в
- •Вариант 2
- •Укажите реакцию открытия иона so42-:
- •Введение ионов калия вызывает:
- •Часть в
- •Вариант 3
- •Вещества, содержащие только ковалентные полярные химические связи, приведены в ряду:
- •Для соединения [Ag(nh3)2]oh степень окисления комплексообразователя равна:
- •Патологическое нарушение гетерогенного равновесия в живом организме – это образование:
- •Для соединения k4[Fe(cn)6] координационное число комплексообразователя равно:
- •Часть в
- •Вариант 4
- •Часть в
- •Вариант 5
- •Укажите реакцию открытия аниона Br-:
- •Бромиды применяются в медицинской практике как:
- •1) Кальцинозом
- •2) Изоморфизмом
- •3) Каменной болезнью
- •Температуры
- •Часть в
Часть в
В-1 |
рН эритроцитов равен 7,25. Найти [Н+] и [ОН] (моль/л). |
В-2 |
Буферный раствор приготовлен из 200 мл 0,2н раствора бромноватистой кислоты HBrO (pK = 8,60) и 300 мл 0,15н раствора ее натриевой соли. Как изменится рН при добавлении к нему 50 мл 0,2н раствора HNO3?
|
В-3 |
Больному капельно ежедневно вводят 150 мл 0.3М растворa глюкозы. Сколько мг глюкозы было введено за 5 дней лечения? |
Вариант 5
Укажите реакцию открытия аниона Br-:
1) NaBr + AgNO3 = AgBr¯ + NaNO3
2) 2NaBr + Cl2 = Br2 + 2NaCl
3) 3NaBr + CrCl3 = CrBr3¯ + 3NaCl
4) NaBr + FeBr3 = Na[FeBr4]
Бромиды применяются в медицинской практике как:
1) седативные препараты
2) стимулирующие, возбуждающие препараты
3) слабительное
4) рвотное
Одинаковую электронную конфигурацию имеют атомные частицы:
1) Ca+2 и Cl+7
2) Sc+3 и С1-
3) Na и Ne
4) Не и S+6
Веществом с молекулярной кристаллической решеткой является:
1) Na2SO4
2) K2S
3) H2O
4) K2Cr2O7
Линейное строение имеют молекулы…
1) H2Te, CO2
2) CO2, BeF2
3) BeF2, H2Te
4) H2S, CO2
Ионными соединениями являются …
1) LiCl, CaF2
2) CaF2, SiF4
3) H2Se, LiCl
4) SiF4, H2Se
Для соединения [Pt(NH3)2Cl2] координационное число комплексообразователя равно:
1) 2
2) 4
3) 6
4) 8
Патологический процесс замещения ионов кальция в гидроксофосфате кальция на ионы стронция с образованием менее растворимого соединения Sr5(PO4)3OH называется:
1) Кальцинозом
2) Изоморфизмом
3) Каменной болезнью
4) ацидозм
Верны ли следующие суждения о комплексных соединениях: А – комплексообразователем называется центральный атом Б – лигандами называются ионы слабых электролитов
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
Восстановительные свойства SO2 проявляются в реакции:
1) + H2S
2) + KMnO4 + H2O
3) + NaOH
4) + H2O
Окислителем в реакции KMnO4 + KNO2 + H2SO4 = K2SO4 + MnSO4 + KNO3 + H2O является:
1) H2SO4
2) KNO2
3) MnSO4
4) KMnO4
Ионная сила раствора – это:
1) произведение концентрации иона на квадрат его заряда
2) произведение концентрации иона на его заряд
3) сумма произведения концентрации ионов на квадрат их зарядов
4) полусумма произведения концентраций ионов на квадрат их зарядов
К 100 г 5% NaCl добавили 150 г воды. Массовая доля вещества в растворе составляет:
1) 3 %
2) 2 %
3) 4 %
4) 8 %
Коэффициент активности ионов (f) в очень разбавленных растворах равен:
1)
![]()
2)
![]()
3)
![]()
4)
![]()
При добавлении HCI к буферной системе NH4CI / NH4OH
1) концентрация NH4CI уменьшается, концентрация NH4OH увеличивается
2) концентрация NH4CI увеличивается, концентрация NH4OH уменьшается
3) увеличиваются обе концентрации
4) концентрации компонентов не меняются
Усилить гидролиз соли NaCH3COO можно добавление:
1) NaOH
2) KCN
3) HCl
4) KCl
Кислую среду, имеет водный раствор:
1) KCl
2) Nа2S
3) NH4CH3COO
4) FeCl3
Формула
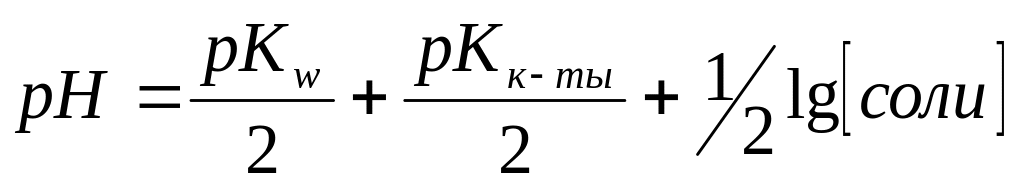 применима
для соли:
применима
для соли:
1) Na2CO3
2) NH4ClO4
3) ZnSO4
4) NH4CN
При физиологическом значении рН=7,36 соотношение [ HPO42- ] / [ H2PO4- ] равно:
1) 20:1
2) 10:1
3) 16:3
4) 4:1
Укажите, какая из приведенных смесей электролитов может проявлять буферные свойства:
1) Na2CO3, NaOH
2) Н3РО4, NaCl
3) CH3COONa, NaCl
4) H3PO4, NaH2PO4
В каком объемном отношении смешали 0,1н растворы NH4CI и NH4OH ( рК=4,76 ), если рН буферного раствора равно 9,24:
1) 1:2
2) 2:1
3) 1:1
4) 2:3
Эквивалент вещества - это:
1) реальная частица вещества, которая в данной реакции эквивалентна одному иону водорода или одному электрону
2) условная частица вещества, которая в данной реакции эквивалентна одному иону водорода или одному электрону
3) реальная или условная частица, которая в данной реакции эквивалентна одному иону водорода или одному электрону
4) условная частица вещества, которая в данной реакции эквивалентна одному катиону или одному аниону
В комплексонометрии определение большинства катионов проводят обычно в:
1) нейтральной среде
2) в ацетатном буфере
3) в аммиачном буфере
4) в бикарбонатном буфере
Приведенные схемы реакций а ) Na2ЭО4 + H2SO4 → Na2Э2О7 + Na2SO4 + H2O
б) Na2Э2О7 + H2SO4(конц) → ЭО3 + Na2SO4 + H2O характерны для соединений элемента:
1) Fe
2) Cu
3) Cr
4) Zn
Кремнийсодержащие вещества X и Y в цепочке превращений SiCl4
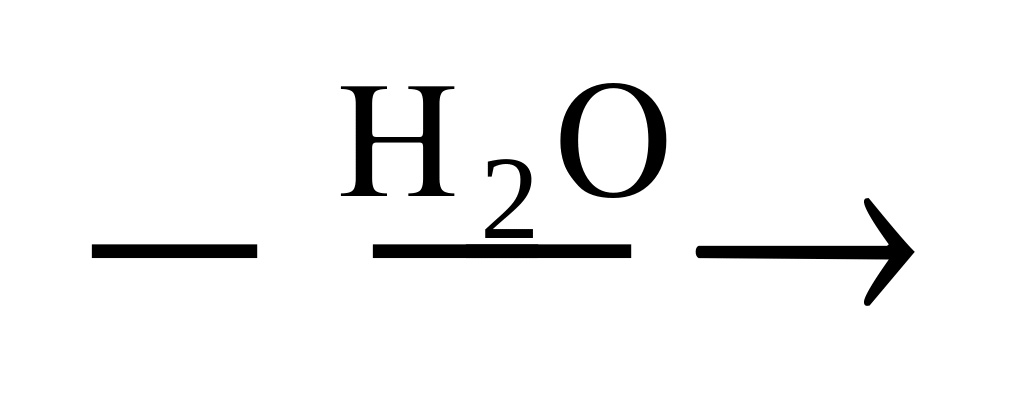 X
X
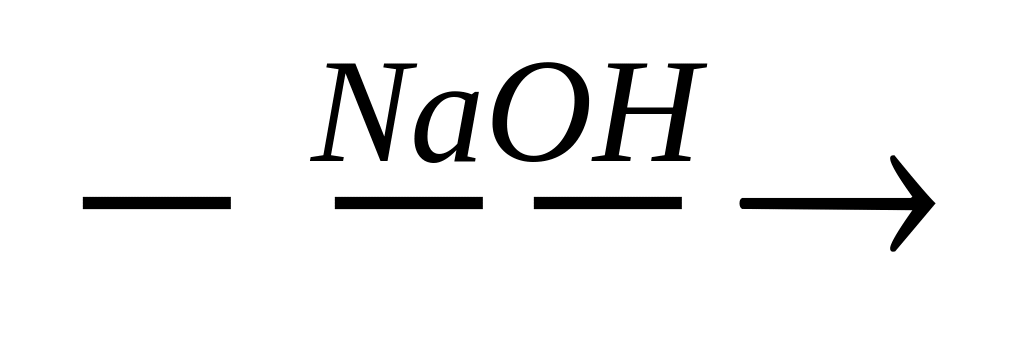 Y
Y
1) Х - Si, Y - Na4Si
2) X - Н2SiO3, Y – Na2SiO3
3) X - Si, Y - Na2SiO3
4) Х - SiС12,Y - Na2SiO3
А) Na2ЭO4 + Н2SO4 → Na2Э2O7 + Na2SO4 + Н2O Б) Na2Э2O7 + Н2SO4(КОНЦ) → ЭO3 + Na2SO4 + Н2O
Приведенные схемы реакций характерны для соединений элемента
1) Fе
2) Сu
3) Zn
4) Сг
Химическое равновесие в системе CO2 (Г) + C(ТВ) ↔ 2СO (Г) − Q сместится вправо при
повышении давления
понижении температуры
повышении концентрации СО
повышении температуры
В системе 2SO2 (Г) + O2(Г) ↔ 2SO3(Г) + Q смещение химического равновесия вправо произойдет при
добавлении катализатора
повышении температуры
увеличении концентрации оксида серы (VI)
повышении давления
Увеличение давления смещает положение равновесия в ту же сторону, что и повышение температуры
1)
2Н2+
O2(Г)
![]() 2Н2O(Г)
+ Q
2Н2O(Г)
+ Q
2) Fe2O3(TB) + ЗСО(Г) 2Fe(ТВ) + 3СO (Г) − Q
3) N2(Г) + ЗН2(Г) 2NH3(Г) + Q
4) СO (Г)+ 2Н2(Г) СН3OH(Г) − Q
Условие необратимости химического превращения:
появление запаха
углубление окраски раствора
протекание реакции в растворе
образование нерастворимого вещества
Если температурный коэффициент химической реакции равен 3, то при повышении температуры от 10 до 40оС скорость реакции:
1) увеличивается в 27 раз
2) уменьшается в 8 раз
3) увеличивается в 7 раз
4) увеличивается в 3 раза
Скорость прямой химической реакции А1(ОН)3(ТВ) + ЗН+ = А13+ + ЗН2O не зависит от
