
- •Контрольные задачи к теме 1
- •Тема 2. Строение атома
- •Контрольные задачи к теме 2
- •Тема 3. Химическая кинетика и химическое равновесие
- •Контрольные задачи к теме 3
- •Тема 4. Растворы. Способы выражения концентрации растворов.
- •Контрольные задачи к теме4
- •Тема 5. Ионно-молекулярные реакции обмена.
- •Контрольные задачи к теме 5
- •Тема 6. Гидролиз солей
- •Контрольные задачи к теме 6
- •Тема 7. Окислительно-восстановительные реакции
- •Контрольные задачи к теме 7
- •Тема 8. Электрохимия
- •Пример 1. Сколько меди выделится на катоде, если через раствор медного купороса пропустить ток силой 2,68 а в течение 30 мин?
- •3600 Кл электричества выделит х г
- •3600 Кл электричества выделит y г
- •Контрольные задачи к теме 8(часть1) (Электродные потенциалы, гальванический элемент)
- •Контрольные задачи к теме 8(часть 2)
- •Тема 9. Коррозия металлов
- •Контрольные задачи к теме 9
Контрольные задачи к теме 2
Сколько протонов и нейтронов содержат ядра изотопов указанных элементов. Приведите электронную и электронно-графическую формулы элемента. Подчеркните валентные электроны. Укажите положение элемента в Периодической системе (период, группа, подгруппа) и приведите возможные степени окисления элемента в невозбужденном и возбужденном состояниях. Охарактеризуйте его основные химические свойства. Приведите формулы оксидов, гидроксидов, гидридов элемента (при их наличии).
№ вар |
Изотопы элемента |
№ вар |
Изотопы элемента |
||||||
1 |
32 16 |
S |
33 16 |
S |
14 |
78 34 |
Se |
82 34 |
Se |
2 |
23 11 |
Na |
24 11 |
Na |
15 |
30 15 |
P |
32 15 |
P |
3 |
55 25 |
Mn |
54 25 |
Mn |
16 |
81 35 |
Br |
79 35 |
Br |
4 |
57 28 |
Mg |
60 28 |
Mg |
17 |
35 17 |
Cl |
37 17 |
Cl |
5 |
52 24 |
Cr |
53 24 |
Cr |
18 |
48 21 |
Sc |
44 21 |
Sc |
6 |
57 28 |
Ni |
60 28 |
Ni |
19 |
78 34 |
Se |
82 34 |
Se |
7 |
55 26 |
Fe |
56 26 |
Fe |
20 |
47 22 |
Ti |
48 22 |
Ti |
8 |
68 31 |
Ga |
70 31 |
Ga |
21 |
27 13 |
Al |
26 13 |
Al |
9 |
30 14 |
Si |
28 14 |
Si |
22 |
16 8 |
O |
18 8 |
O |
10 |
39 19 |
K |
40 19 |
K |
23 |
50 23 |
V |
52 23 |
V |
11 |
19 9 |
F |
18 9 |
F |
24 |
63 29 |
Cu |
64 29 |
Cu |
12 |
55 25 |
Mn |
56 25 |
Mn |
25 |
65 30 |
Zn |
66 30 |
Zn |
13 |
42 20 |
Ca |
40 20 |
Ca |
|
|
|
|
|
Тема 3. Химическая кинетика и химическое равновесие
Раздел химии, изучающий скорости и механизмы химических реакций и влияние на них различных факторов, называется химической кинетикой.
Скорость
гомогенной реакции определяется
изменением концентрации одного из
вступивших в реакцию или образующихся
в результате реакции веществ в единицу
времени :
![]() ;
где С – концентрация,
;
где С – концентрация,
![]() -
время.
-
время.
Скорость гетерогенной реакции определяется числом молей веществ, вступивших в реакцию или образующихся в результате реакции в единицу времени на единице поверхности фазы.
![]() ;
;
где ν-количество вещества; τ-время; S-площадь поверхности
Важнейшими факторами, влияющими на скорость реакций, являются: природа реагирующих веществ, температура, концентрация реагентов, давление, катализатор.
Количественная зависимость скорости реакции от концентрации реагентов описывается законом действующих масс: Скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, возведенных в степени, равные соответствующим коэффициентам в уравнении реакции. Например для реакции :
а А + b В = с С + d D
ωпрямой = к[A]a·[B]b ,
где к- константа скорости реакции;
[A],[B]-молярные концентрации реагирующих веществ
Для гетерогенных реакций концентрации твердой фазы в выражение скорости реакции не входит.
Скорость большинства реакций увеличивается в 2-4 раза при повышении температуры на 10 градусов (правило Вант-Гоффа). Величина, показывающая, во сколько раз возрастает скорость данной реакции при увеличении температуры на каждые 10 градусов, называется температурным коэффициентом.
![]() ,
,
где t2 и t1 - температура реакции;
![]() -
скорость реакции при данных температурах;
-
скорость реакции при данных температурах;
γ - температурный коэффициент.
Если реакция протекает только в одном направлении, она называется необратимой. Обратимыми называются реакции, которые могут протекать одновременно в противоположных направлениях:
a A + b B ↔ c C + d D
Состояние процесса, в котором скорость прямой и обратной реакции равны, называется химическим равновесием. В этом случае
ωпрямой = ωобратной , т.е. кпр[A]a·[B]b= кобр[C]c·[D]d
Отношение
констант прямой и обратной реакций
называется константой
равновесия:
![]()
Константа химического равновесия зависит от природы реагентов и температуры, но не зависит от концентрации реагирующих веществ и катализатора.
При неизменных условиях состояние химического равновесия сохраняется сколь угодно долго. Сместить его в сторону прямой или обратной реакции можно, изменяя внешние условия протекания реакций
(температуру, концентрацию веществ, давление).
Направление смещения химического равновесия определяется принципом Ле-Шателье (1884 г.): Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то равновесие сместится в сторону уменьшения этого воздействия.
Пример 1. Определите, как изменится скорость прямой реакции
2СО + О2 = 2СО2 если давление в системе увеличить в 4 раза.
Решение: При увеличение давления в системе в 4 раза произойдет уменьшение объёма системы в 4 раза, а следовательно концентрации реагирующих веществ возрастет в 4 раза.
Согласно закону действующих масс скорость гомогенной реакции в начальный момент времени равна ω1 = к [CO]2 · [O2] , после увеличения давления ω2 = к [4CO]2 · [4O2] = 43 к [CO]2 · [O2] = 64 к [CO]2 · [O2]
Следовательно после увеличения давления в 4 раза скорость реакции возросла в 64 раза.
Пример 2. Температурный коэффициент скорости реакции равен 3. Во сколько раз изменится скорость реакции при повышении температуры от 15 до 55оС?
Решение: Определим на сколько градусов повысилась температура
Δt
= t1
– t2
= 55 – 15 = 40. Используя правило Вант- Гоффа
определяем во сколько раз возрастет
скорость реакции
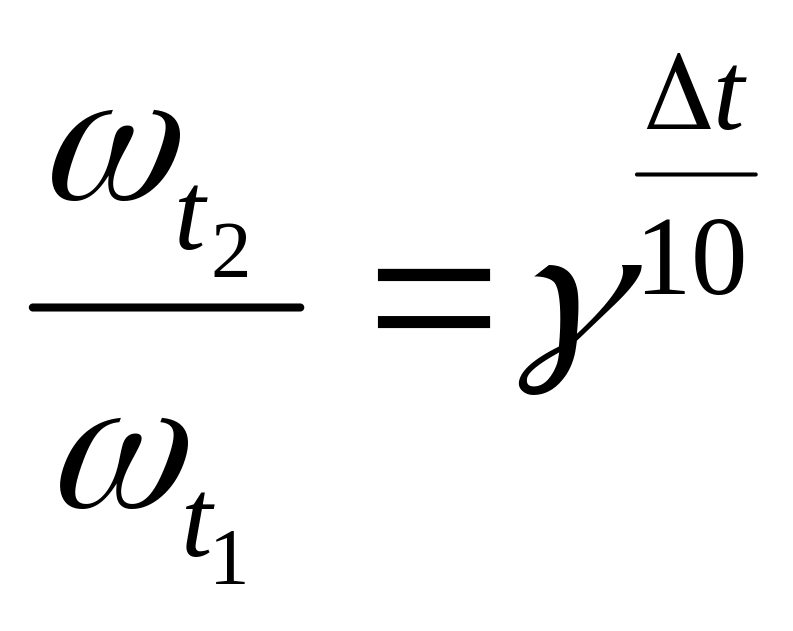 следовательно
следовательно
![]() =
34=81
раз.
=
34=81
раз.
Пример 3. Исходные концентрации водорода и азота равны соответственно 0,6 и 1 моль/дм3. К моменту равновесия прореагировало 50% водорода. Вычислите Кравн реакции синтеза аммиака.
Решение:
Реакция протекает по уравнению 3Н2
(г)+
N2(г)↔
2NH3(г).
Если прореагировало 50% водорода т.е. 0,3
моль/дм3,
следовательно равновесная концентрация
водорода [H2]равн=
0,6 – 0,3 = 0,3 моль/дм3.
По уравнению реакции азота прореагирует
в три раза меньше, т.е.
![]() 0,1моль/дм3,
следовательно равновесная концентрация
азота [N2]равн=
1-0,1 = 0,9 моль/дм3.
Количество образовавшегося аммиака
будет равно 0,2 моль/дм3,
т.е. [NH3]равн=0,2
моль/дм3.
Для данной реакции Кравн
вычисляем по формуле:
0,1моль/дм3,
следовательно равновесная концентрация
азота [N2]равн=
1-0,1 = 0,9 моль/дм3.
Количество образовавшегося аммиака
будет равно 0,2 моль/дм3,
т.е. [NH3]равн=0,2
моль/дм3.
Для данной реакции Кравн
вычисляем по формуле:

