
- •Электрофильные реакции с олефинами и ароматическими двойными связями
- •Реакционная способность двойной связи
- •Механизм реакций электрофильного присоединения к олефинам
- •Процентное содержание продукта присоединения к олефинам по правилу Марковникова
- •Катионная цепная полимеризация
- •Электрофильное присоединение к сопряженным диенам
- •Электрофильное присоединение к ацетиленам
- •Стереохимия реакций электрофильного присоединения
Процентное содержание продукта присоединения к олефинам по правилу Марковникова
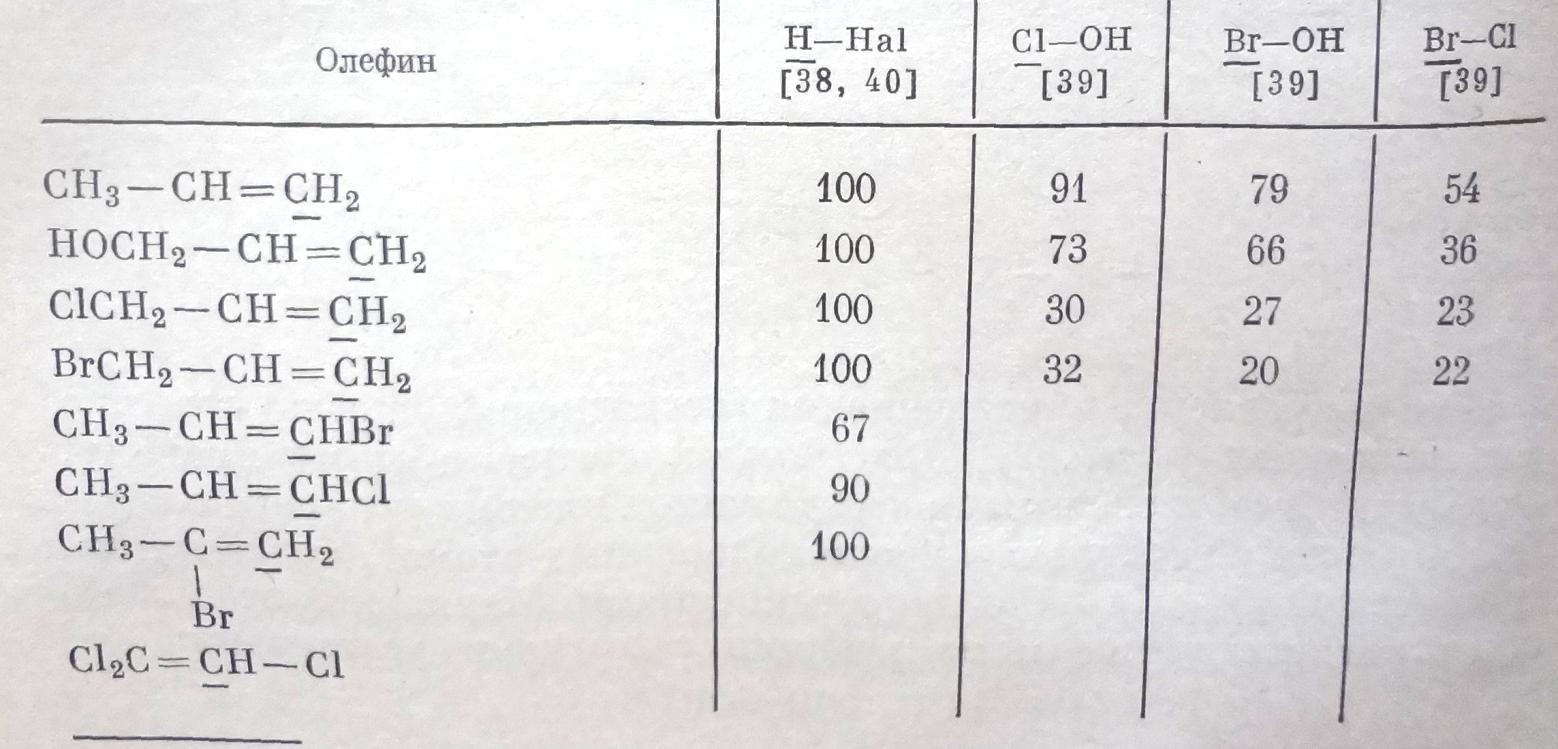
Собранные в табл. 7.1 примеры присоединения галогеноводородных кислот относятся к реакциям, которые проводились в присутствии электрофильного катализатора. Такой катализатор (кислоты Льюиса: тригалогениды железа или алюминия) необходим для активации мало реакционноспособного хлористого водорода. В случае бромистого водорода катализатор помогает также подавить возможную в этом случае радикальную реакцию.
Оставив пока в стороне 1-хлор- и 1-бромпропен, мы можем сказать, что присоединение галогеноводородов строго следует правилу Марковникова; индукционный эффект групп СlСН2 или ВгСН2 в аллилхлориде и соответственно аллилбромиде еще не достаточен для того, чтобы существенно повлиять на предпочтительность образования катиона, ведущего к присоединению по правилу Марковникова. В случае 1,1-дихлорпропена-2 также еще сохраняется ориентация по правилу Марковникова. Лишь в случае 1,1,1-трихлорпропена-2 частично получается продукт присоединения против правила Марковникова, в частности с HI – 3-иод-1,1,1-трихлорпропан.
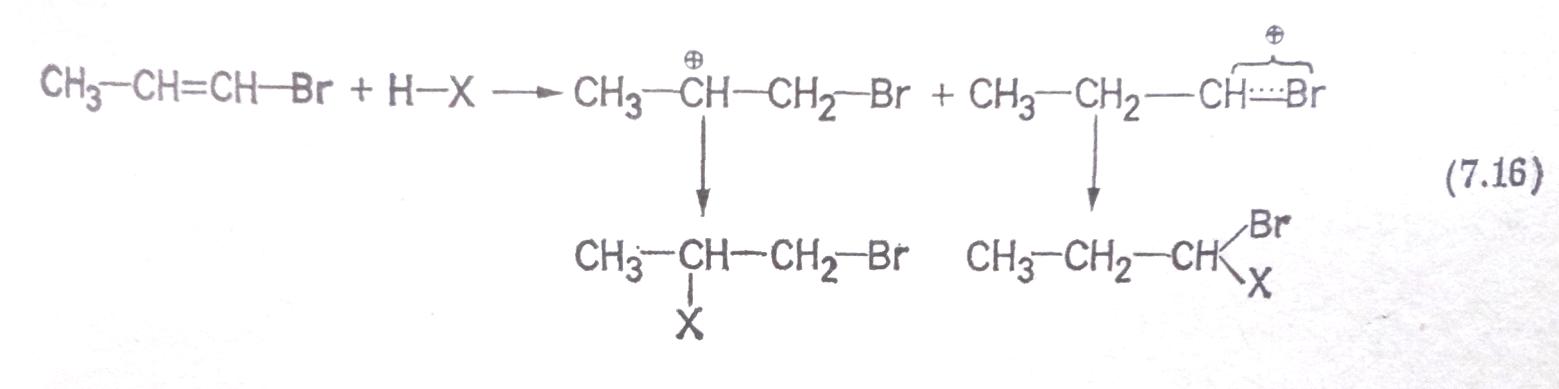
Появление антимарковниковского продукта при присоединении галогеноводородов к 1-бромпропену и 1-хлорпропену можно объяснить тем, что галогены своим +М-эффектом стабилизуют катион, ведущий к присоединению против правила Марковникова (см. схему (7.16)), что невозможно в случае аллильной системы (3-хлор- или 3-бромпропен), поскольку атом галогена и карбкатионный углерод не сопряжены [схема (7.17)]:
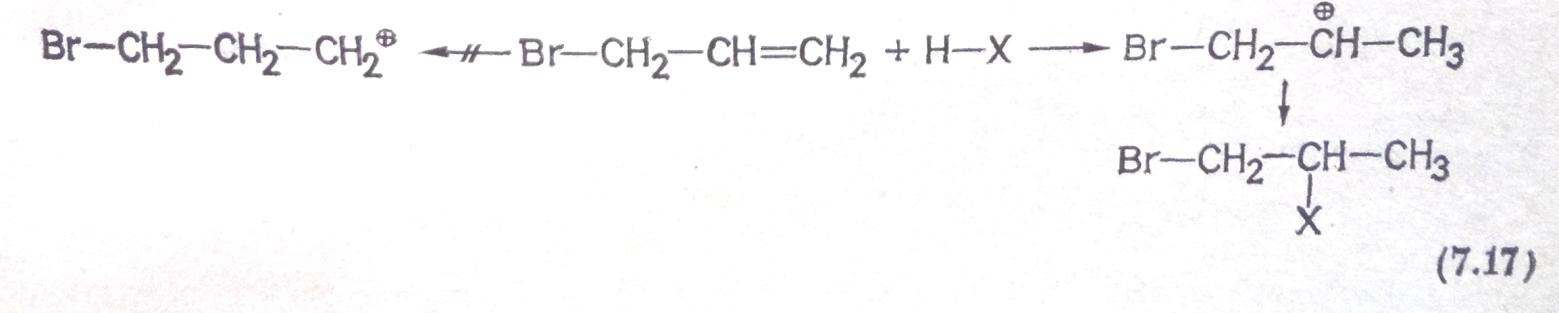
Кроме того, отклонения от правила Марковникова связаны еще с другим явлением: в противоположность карбкатионам, возникающим при присоединении галогеноводородов, воды и т. д., карбкатионы, образующиеся при присоединении галоген-катиона, могут относительно легко изомеризоваться, поскольку галоген проявляет эффект «соседней группы». Это влияние в условиях реакции может перейти в своего рода внутреннее SN2-переходное состояние (правда, с изогнутыми связями) или промежуточную ступень типа галогенониевой структуры [2б на схеме (7.18)].

Каждый из образующихся таким путем промежуточных продуктов образует свой конечный продукт, причем симметричный галогенониевый ион (2б) может быть атакован и по концевому атому углерода, как это известно для аналогичных эпоксидов. Галогенониевые ионы типа 2б на схеме (7.18) действительно удалось получить в системе SbF5/жидкаяSО2; их строение определено методом ЯМР.
Атом галогена, имеющийся в молекуле олефина, также может посредством своего влияния как соседней группы вызывать перегруппировки:
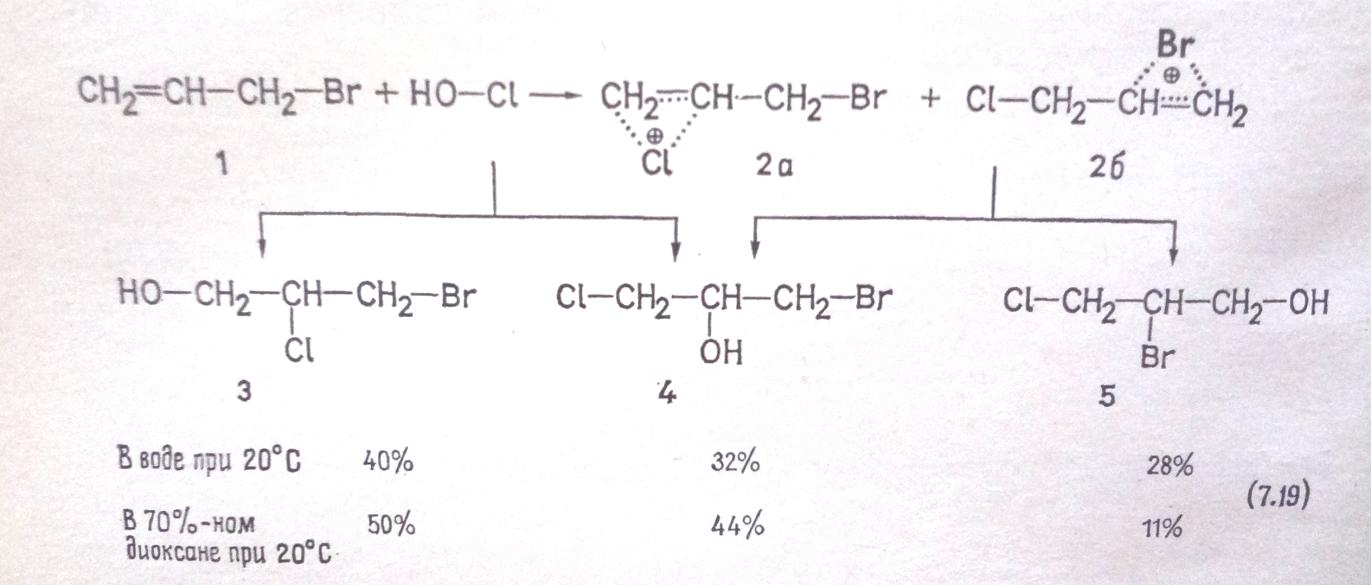
Тенденция к перегруппировке промежуточного продукта 2б возрастает от хлора к иоду. Для реакции с НОС1 найдены следующие процентные доли продукта перегруппировки [отвечающие формуле 5 схемы (7.19)]: из СH2=CH–СН2–С1 4%; из СН2=СН–СН2–Вг 28% [см. схему (7.19)]; из СН2=СН–СН2–I 48% [44].
Степень перегруппировки зависит также и от растворителя. Она возрастает с увеличением времени жизни карбкатиона, как этого и следует ожидать. На соотношение же продуктов присоединения по правилу Марковникова или против него растворитель влияет мало.
Тот факт, что при реакции (7.19) образуется 40% продукта присоединения против правила Марковникова (формула 3) и только 28% продукта перегруппировки (формула 5), заставляет прийти к выводу, что вновь вступающий атом галогена вызывает перегруппировку более активно, чем уже имеющийся в молекуле. При соответствующей реакции аллилхлорида (использовался меченый исходный продукт СН2=СН–СН2–35С1) с HOС1 получается 70% продукта присоединения против правила Марковникова и только 4% продукта перегруппировки.
Присоединение бромистого водорода к олефинам нередко идет аномально, приводя к образованию исключительно антимарковниковского продукта. Речь идет в данных случаях о реакции совершенно иного механизма, который был выяснен Харашем. Аномальная реакция всегда происходит в присутствии света, кислорода или перекисей. При исключении этих факторов реакция дает обычный продукт, отвечающий правилу Марковникова; этот же продукт образуется и в присутствии кислот Льюиса. «Перекисный эффект», несомненно, объясняется радикальным механизмом:

Чтобы избежать радикальной реакции, лучше всего добавить кислоту Льюиса (А1Вг8), сильно ускоряющую ионные реакции. Из всех галогеноводородов лишь бромистый водород обнаруживает перекисный эффект: радикалы хлора имеют более высокую энергию и поэтому не могут воссоздаваться в обычных условиях проведения реакции присоединения, тогда как относительно легко образующиеся радикалы иода слишком бедны энергией и не способны образовать цепь, конкурирующую с ионной реакцией.
