
Федеральное агентство по образованию РФ
Тверской Государственный Технический Университет
Кафедра «Биотехнологии и Химии»
Методическое указание к практикуму по физической химии
Лабораторная работа № 1
«Определение содержания кристаллизационной воды в соли
методом калориметрии»
Тверь 2006
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Термодинамика и термохимия
Термодинамической системой называется тело или совокупность тел, находящихся во взаимодействии и условно обособленных от окружающей среды. Системы, обменивающиеся с окружающей средой и веществом и энергией, называют открытыми системами. Системы, обменивающиеся только энергией, называют закрытыми. Системы, не обменивающиеся ни веществом, ни энергией, называют изолированными.
Совокупность всех физических и химических свойств системы характеризует ее состояние.
Состояние системы характеризуется термодинамическими параметрами и функциями. К параметрам состояния относят переменные величины, которые непосредственно могут быть заданы и измерены: температура Т, объем V, давление Р. Уравнение, описывающее взаимосвязь параметров состояния, называется уравнением состояния. Так, для идеального газа применимо уравнение состояния Менделеева-Клапейрона: PV =vRT,
где v- количество газа; R - универсальная газовая постоянная.
К термодинамическим функциям относят переменные величины, зависящие от параметров состояния, которые не могут быть непосредственно измерены. Их делят на функции процесса: теплота Q и механическая работа А, и функции состояния: внутренняя энергия U, энтальпия Н, энтропия S, изобарно-изотермический потенциал (свободная энергия Гиббса) G и изохорно-изотермический потенциал (свободная энергия Гельмгольца) F.
Термодинамическим процессом называется всякое изменение в системе, связанное с изменением хотя бы одного термодинамического параметра.
Изменение функций состояния не зависит от пути и способа проведения процесса, а зависит только от начального и конечного состояния системы. Изменение функций процесса зависит от того, при каких условиях и каким путем протекает процесс.
Термодинамика базируется на двух фундаментальных законах (началах), являющихся всеобщими законами природы. Они не могут быть выведены, но и не могут быть отвергнуты, поэтому рассматриваются как постулаты.
Первый закон термодинамики
Первый закон термодинамики — это закон сохранения энергии в изолированной системе.
Теплота Q, переданная системе, идет на увеличение ее внутренней энергии dU и на совершение работы системой против внешних сил:
Q = ∆U+A.
Для бесконечно малого изменения величин:
δQ = dU +δА
бесконечно малое изменение функций состояния принято обозначать буквой d, а функций процесса — буквой δ. Внутренняя энергия — это общий запас энергии системы, включающей кинетическую и потенциальную энергию частиц, входящих в систему. Абсолютную величину внутренней энергии системы определить невозможно, но можно определить ее изменение при переходе системы из начального состояния в конечное:
![]()
При увеличении внутренней энергии ∆U<0, при уменьшении ∆U < О.Работа процесса — это энергия, передаваемая одним телом другому при их взаимодействии. В химической термодинамике обычно рассматривается работа расширения газа
А = р•∆V. Если система совершает работу, то величина А положительна, поскольку
∆V = Vкон – Vнач > 0.
Поскольку работа является функцией процесса, ее изменение:
![]()
Термохимия. Тепловые эффекты химических реакций
Термохимия — раздел физической химии, изучающий тепловые эффекты химических реакций и физико-химических процессов: кристаллизации, гидратации, растворения и др.
Тепловым эффектом называется количество теплоты, которое выделяется или поглощается при протекании химической реакции. При этом должно соблюдаться условие, чтобы система не совершала никакой работы, кроме расширения.
Если теплота поглощается системой, т. е. процесс является эндотермическим, величина Q берется со знаком «плюс». В случае выделения тепла (экзотермический процесс), величина Q берется со знаком «минус».
Закон гесса.
Для двух практически важных процессов — изохорного и изобарного — теплота процесса равна изменению функций состояния и приобретает свойства функций состояния, т. е. она не зависит от пути протекания процесса, а определяется начальным и конечным состояниями системы.
Это положение является основным постулатом термохимии, сформулированным в 1840 г. русским химиком Г. И. Гессом и называемым законом Гесса.
Закон Гесса позволяет вычислить тепловой эффект реакции, если по каким-либо причинам его невозможно определить экспериментально.
Например, непосредственно измерить тепловой эффект реакции
С(тв) + 0,5O2(г) = СO(г)
не удается, поскольку при сжигании твердого углерода наряду с СО всегда образуется CO2. Однако тепловой эффект данной реакции ∆Hx можно рассчитать, измерив его для двух других реакций:
1)C(тв) + O2(г) = СO2(г), ∆H1
2)CO(г) + 0.5O2(г) = СO2(г), ∆H2
Вычитая из первого уравнения второе, получим искомое уравнение:
С(тв) + 0.5О2(Г) = СО(Г) ∆HХ
В соответствии с законом Гесса: ∆HХ = ∆H1 - ∆H2.
Следствия из закона гесса
Из закона Гесса вытекают два следствия, которые позволяют определить тепловые эффекты химических реакций, не прибегая к измерениям.
Первое следствие из закона Гесса: тепловой эффект химической реакции при стандартных условиях равен сумме стандартных теплот образования продуктов реакции, умноженных на стехиометрические коэффициенты, минус стандартные теплоты образования исходных веществ, умноженные на соответствующие коэффициенты.
Теплотой образования ∆Нf, сложного вещества называется тепловой эффект реакции образования 1 моля данного вещества из простых. Теплоты образования простых веществ равны нулю.
Теплоты образования ∆Н°f,298 многочисленных соединений при стандартных условиях: давлении 1 атм и температуре 25°С (298 К), приводятся в термодинамических таблицах .
Теплоемкостью с называют количество теплоты, необходимое для нагревания 1 г (удельная теплоемкость) или 1 моля (молярная теплоемкость) вещества на 1 К.
![]()
Теплоемкость твердых, жидких и газообразных веществ увеличивается при повышении температуры.
Различают истинную теплоемкость, т. е. теплоемкость при данной температуре
![]()
и среднюю теплоемкость
![]()
соответствующую конечному интервалу температур. Если этот интервал невелик, теплоемкость можно считать не зависящей от температуры.
В зависимости от условий нагревания теплоемкость может быть изобарной cp и изохорной cv:
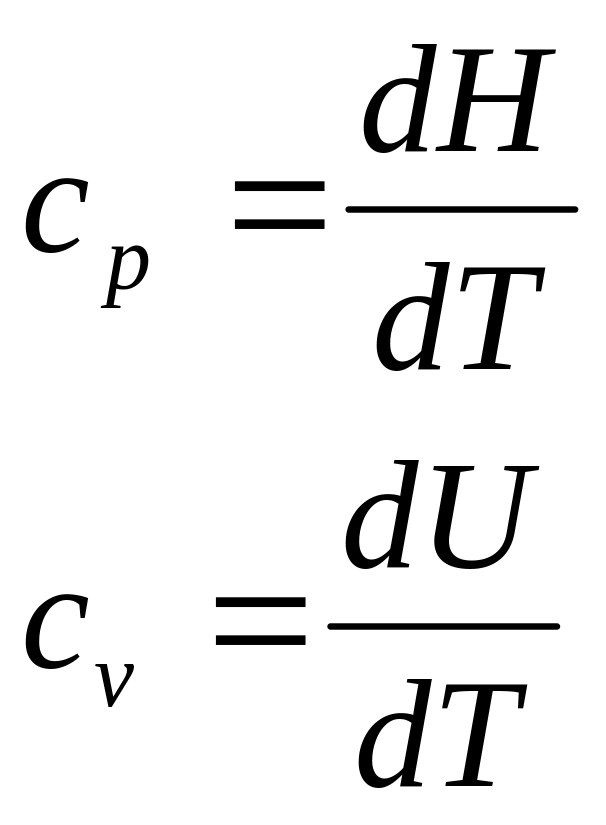
Для выяснения зависимости теплового эффекта от температуры продифференцируем уравнение:
![]()
Учитывая выше написанное уравнение:
![]()
Это уравнение называется уравнением Кирхгофа. В этом уравнении величина ∆ср – это разность молярных теплоемкостей продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов.
Для вычисления теплового эффекта реакции при заданной температуре T, необходимо проинтегрировать уравнение Кирхгофа:
![]()
![]()
Работа 1
Определение содержания кристаллизационной воды
в соли методом калориметрии
Цель работы: определение теплоты растворения соли в воде.
Приборы и реактивы.
Для определения тепловых эффектов процессов применяются калориметрические установки. Конструкция калориметрической установки зависит от особенностей изучаемого процесса. Простейшая калориметрическая установка представляет собой калориметрический стакан с крышкой, в которой закреплены термометр Бекмана и проволочная мешалка. Для уменьшения теплообмена с окружающей средой стакан помещен в более широкий сосуд для создания воздушной оболочки (рис. 1).
Такого типа калориметрические установки применяются для определения теплоемкостей веществ, теплот растворения солей, теплот разведения, нейтрализации и др.
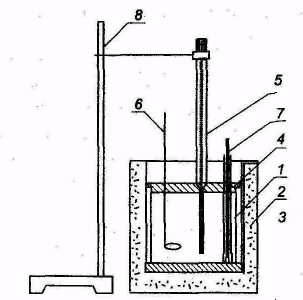
1-калориметрический стакан;2-термостат;
3-подставка; 4 -крышка; 5-термометр Бекмана;
6-мешалка; 7-пипетка; 8-штатив.
Рис.1. Схема калориметра.
Термометр Бекмана. Его настройка.
Поскольку измерения проводятся при низкой температуре, настройка термометра Бекмана должна производиться непосредственно перед измерением.
Шкала термометра составляет 5 градусов, цена одного самого маленького деления на ней равна 0,01°. Невооруженным глазом можно оценить половину этого деления и вести отсчет с точностью до 0,005°, с помощью лупы можно снимать показания с точностью до 0,002°.
Так как шкала составляет 5 градусов, то понижение температуры (∆Т3) не должно превышать 5 градусов. Наличие верхнего резервуара с ртутью, соединенного с нижним резервуаром капилляром, позволяет менять массу ртути в нижнем резервуаре, в зависимости от того, в каком температурном интервале проводятся измерения. Ртути в нижнем резервуаре должно быть столько, чтобы при замерзании чистого растворителя мениск ртути находился в верхней части шкалы. При работе с водными растворами положение мениска ртути в этой зоне должно отвечать 0°С. Для установления нулевой точки помещают термометр в тающий лед и отмечают уровень ртути в капилляре. Если он окажется в нижней части шкалы, то следует добавить ртуть из верхнего резервуара в нижний. Для этого, перевернув термометр, зажать верхнюю его часть в кулак и не сильно постучать кулаком по столу, придерживая нижний конец термометра другой рукой. При этом ртуть начнет перетекать из нижнего резервуара в верхний. Когда ртуть заполнит капилляр и сольется со ртутью, находящейся в верхнем резервуаре, следует осторожно перевернуть термометр так, чтобы верхний резервуар оказался несколько выше нижнего тогда ртуть из него будет перетекать в нижний. Чтобы ускорить этот процесс, нижний резервуар можно поместить под струю холодной воды. После того как некоторое количество ртути из верхнего резервуара перетечет в нижний, термометр надо перевести в вертикальное положение и погрузить в лед. Через несколько минут вынуть термометр изо льда, и, держа его правой рукой за среднюю часть, коротким, но сильным ударом верхней части термометра по большому или указательному пальцу левой руки добиться разрыва столбика ртути в месте соединения капилляра с верхним резервуаром ртути. Затем снова поставить термометр в тающий лед и наблюдать положение мениска ртути. Если ртуть на этот раз окажется выше делений шкалы, то вынуть термометр изо льда, слегка нагреть нижний резервуар рукой и скопившуюся в капилляре над верхним резервуаром капельку ртути сбросить в него резким ударом верхней части термометра по большому пальцу левой руки. Эти операции иногда приходится повторять несколько раз, чтобы добиться желаемого положения ртути на шкале термометра.
Приборы и реактивы: калориметрическая установка; аналитические весы; мерный цилиндр на 300 см3; секундомер; хлорид калия; исследуемая соль: нитрат калия, сульфат калия, нитрат аммония, сульфат меди.
