- •1 Литературный обзор
- •Источники лакказы в природе
- •Материалы и методы исследования
- •2.1.1 Объекты исследования
- •2.2.6 Исследование внутриклеточной лакказной активности грибов
- •2.2.7 Исследование влияния индукторов на лакказную активности исследуемых грибов
- •2.2.9 Определение кислотоводорастворимого лигнина в гидролизатах
- •2.2.10 Исследование трансформации кислотоводорастворимого лигнина гидролизатов
- •2.2.11 Исследование деградации кислотоводорастворимого лигнина гидролизатов
- •2.2.12 Определение лигнина методом Класона в модификации Комарова
- •3. Результаты и обсуждение
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ
УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«Уфимский государственный нефтяной технический университет»
Кафедра биохимии и технологии микробиологических производств
РЕЦЕНЗЕНТ К ЗАЩИТЕ ДОПУЩЕН
Доцент БГАУ Зав. кафедрой
___________ Г.М. Рахимова доктор хим. наук, проф.
_______________ 2012 г. __________В.В. Зорин
Доц., канд хим. наук _____________ 2012 г.
___________В.Г. Сафарова
______________ 2012 г.
МАГИСТЕРСКАЯ ДИССЕРТАЦИЯ
по направлению подготовки «Химическая технология и биотехнология»
по программе «Промышленная биотехнология и биоинженерия»
на тему:
Исследование лакказной активности микроорганизмов
Магистрант Закирова Лиана Ильясовна
Научный руководитель
доцент, канд.техн.наук Л.Х. Халимова
Нормоконтролер Ф.А. Прищепов
УФА 2012
СОДЕРЖАНИЕ
|
||||
1..2 Источники лакказы в природе 8 |
||||
1.2 Основные свойства лакказ 10 |
||||
1..3 Структурная организация молекулы лакказы 12 |
||||
|
||||
|
||||
|
||||
1...7 Области применения лакказ 21 |
||||
1.8 Роль грибных лакказ в биодеградации лигнина 23 |
||||
1.9 Роль грибных лакказ в деградации ксенобиотиков 25 |
||||
2 МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ |
||||
2.1.1 Объекты исследования 30 |
||||
2.1.2 Материалы исследования 30 |
||||
2.1.3 Методы и среды для культивирования грибов 32 |
||||
2.2.3 Определение ферментативной активности лакказы 35 |
||||
2.2.4 Определение белка по методу Лоури 37 |
||||
2.2.5 Модифицированная реакция Бавендамма 38 |
||||
2.2.6 Исследование внутриклеточной лакказной активности грибов 38 |
||||
2.2.7 Исследование влияния индукторов на лакказную активности исследуемых грибов 39 |
||||
2.2.8 Исследование влияния субстрата (косубстрата) на лакказную активность исследуемых грибов 40 |
||||
2.2.9 Определение кислотоводорастворимого лигнина в гидролизатах |
||||
лигноцеллюлозы по методу Класона 40 |
||||
2.2.10 Исследование трансформации кислотоводорастворимого лигнина гидролизатов лигноцеллюлозных материалов 41 |
||||
2.2.11 Исследование деградации кислотоводорастворимого лигнина гидрИлизатов лигноцеллюлозных материалов 41 |
||||
2.2.12 Определение лигнина методом Класона в модификации Комарова 42 |
||||
2.2.12 Определение эмульгирующей способности культуры грибов 43 |
||||
3 РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ |
||||
3.1 Поиск микроорганизмов - продуцентов лакказ 41 |
||||
3.2.1 Подбор состава питательных сред для эффективного синтеза |
||||
лаказ исследуемых грибов 49 |
||||
3.2.2 Определение эффективности лакказы грибов, выращенных в условиях глубиннной и поверхностной культуры 49 |
||||
3.2.3 Влияние длительности глубинного культивирования |
||||
грибных продуцентов на лакказную активность 50 |
||||
3.2.4 Исследование влияния состава питательной среды на рост и лакказную активность микроорганизмов 52 |
||||
3.2.5 Исследование влияния среды культивирования на рост и лакказную активность мицелиальных продуцентов лакказы 57 |
||||
3.3 Исследовние субстратной специфичности 61 |
||||
3.4 Исследование способности грибов обесцвечивать красители 63 |
||||
3.5. Исследование влияния низкомолекулярных индукторов на рост и лакказную активность мицелиальных грибов 64 |
||||
3.4.1 Исследование влияния синтетических индукторов на биосинтез лакказы микроорганизмами 66 |
||||
3.4.2 Исследование влияния органических индукторов на рост и лакказную активность грибов 68 |
||||
3.5.1 Исследование субстратной специфичности грибных лакказ 76 |
||||
3.5.2 Исследование зависимости лакказной активности от 80 температуры |
||||
3.5.3 Исследование зависимости лакказной активности от рН 85 |
||||
3.5.4 Исследование влияния концентраций субстратов на лакказную активность исследуемых мицелиальных грибов 86 |
||||
3.5.5 Исследование локализации фермента лакказы у исследуемых грибов в реакциях трансформации пирокатехина 87 |
||||
3.5.6 Исследование лакказной активности грибов при росте на среде с эозином 88 |
||||
3.5.7 Исследование условий трансформации органических соединений клеточными лакказами 89 |
||||
3.5.8 Исследование биодеградации п-нитрофенола 91 |
||||
3.6 Исследование способности грибных лакказ стабилизировать эмульсии 98 |
||||
3.6.1 Исследование условий трансформации пирокатехина в биоэмульсиях 103 |
||||
3.7 Исследование трансформации пирокатехина в двухфазных системах 108 |
||||
3.8 Изучение биодеградации лигнина мицелиальными грибами 116 |
||||
3.9 Исследование деградации кислоторастворимого лигнина 120 |
||||
|
ОПРЕДЕЛЕНИЯ, ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ
MnП―марганецпероксидаза
МСО―медьсодержащая оксидаза
ЛП―лигнинпероксидаза
ЛМС―лакказа-медиаторная система
ЛА―лакказная активность
ЭА―эмульгирующая активность
ПК―пирокатехин
РЦ―резорцин
ПГ―пирогаллол
РМ―ремазол
ГХ―гидрохинон
2,6 -ДМФ―2,6-диметилфенол
ЧП ―среда Чапека
ГАС ―глюкозо-аммонийная среда
ГАКЭ― глюкозо-аммонийной среде с добавлением кукурузного экстракта
Ср-КС― среда Королевой-Скоробогатько
ОД―оптическая плотность реакционной смеси
КЖ―культуральная жидкость
ВВЕДЕНИЕ
В настоящее время во всем мире ведется интенсивная разработка технологий на основе базидиальных и мицелиальных лигнинолитических грибов и их ферментов для практических целей.
Уникальной особенностью грибов является способность к синтезу внеклеточных окислительных ферментов: лигнинпероксидаз (ЛП), марганецпероксидаз (MnП), полифункциональных пероксидаз, фенолоксидаз ― лакказ, обладающих широкой субстратной специфичностью, что позволяет им разлагать не только органические вещества природного происхождения, но и различные ксенобиотики.
Лакказа (п-дифенол: кислород оксидоредуктаза, КФ 1.10.3.2)―медьсодержащий фермент, катализирующий окисление субстрата ―донора электронов с сопутствующим восстанавлением молекулярного кислорода до воды без образования в качестве промежуточного продукта перекиси водорода или каких либо других кислородных интермедиатов. Лакказа для катализа не требует кофакторов. Эти качества сделали лакказу одним из наиболее распространенных инструментов в современной биотехнологии.
Применение ферментных препаратов лакказ перспективно во многих областях промышленности: целлюлозо - бумажной (делигнификации бумажной пульпы); текстильной (экологически чистое отбеливание тканей); тонком органическом синтезе (например, синтез электропроводящих полимеров); пищевой (удаление следов кислорода в продуктах питания для увеличения срока хранения); косметической (краска для волос, отбеливающая зубная паста); производстве моющих средств (отбеливающий агент); для биодеградации ксенобиотиков, в том числе отравляющих веществ; синтезе лекарственных препаратов (например, антибиотиков); в биосенсорах (например, анализ фенольных соединений, включая лигнины, в сточных водах промышленных предприятий) определение антиоксидантного статуса продуктов.
В связи с этим производство препаратов лакказ является актуальной задачей биотехнологии. Для использования этих ферментов в индустриальных масштабах требуется их огромное количество. Проблемой является низкая продуктивность используемых микроорганизмов - продуцентов лакказ, что обуславливает их высокую себестоимость. Только понижение себестоимости ферментных препаратов лакказ позволит увеличить масштабы их промышленного производства и использования во многих видах промышленности, сельском хозяйстве, биоремедиации.
Наиболее важными этапами в разработке технологии производства ферментных препаратов лакказ являются выбор высокоактивных штаммов-продуцентов, оптимизация состава питательных сред и условий культивирования на синтез лакказ.
Целью данной работы является поиск новых высокоактивных штаммов ― продуцентов лакказ и исследование лакказной активности в различных условиях культивирования исследуемых грибов.
Для достижения намеченной цели были поставлены следующие задачи:
Поиск новых высокоактивных штаммов мицелиальных грибов и выявление штаммов с повышенным уровнем синтеза лакказ;
Оптимизация условий культивирования продуцентов лакказ и окисления субстратов в неростовых условиях;
3) Выбор и исследование эффективных индукторов лакказ;
4) Исследование биодеградации ксенобиотиков и лигноцеллюлозных материалов препаратов лакказ исследуемых грибов
Практическая значимость. Результаты работы важны для разработки технологий получения препаратов грибных лакказ для делигнификации лигноцеллюлозных материалов и деструкции ксенобиотиков.
Научная новизна: Выделены и исследованы почвенные мицелиальные грибы- продуценты лакказ, подобраны оптимальные условия их культивирования на различных питательных средах; подобраны эффективные индукторы синтеза лакказ и исследованы условия биодеградации ксенобиотиков и лигноцеллюлозных материалов препаратами мицелиальных грибов.
Диссертационная работа выполнена в соответствии с планом научно-исследовательских работ кафедры БТМП УГНТУ (тема« Научно-образовательная деятельность музея микроорганизмов кафедры биохимии и технологии микробиологических производств»).
Работа была проведена в лабораториях биохимии и биотехнологии кафедры БТМП УГНТУ.
Результаты диссертационной работы были апробированы на 62 и 63 научно-технической конференциях студентов, аспирантов и молодых ученых [г. Уфа, УГНТУ, 2011 -2012 гг] , были доложены на VI Межвузовский конкурс научных работ студентов по биотехнологии и экологии (УГНТУ 25 апреля 2012 г).
Опубликованы в материалах в I – ой и II - ой Международной конференции молодых ученых «Актуальные проблемы науки и техники» [г. Уфа, УГНТУ, 8-10 декабря 2010 г.]; в VI Всероссийской научной интернет - конференции «Интеграция науки и высшего образования в области био- и органической химии и биотехнологии» [ г.Уфа, УГНТУ, 9- 25 декабря 2011 г.],
Материалы диссертационной работы опубликованы в 2 статьях в Башкирском химическом журнале [2011, т. 18, № 4].
1 Литературный обзор
Источники лакказы в природе
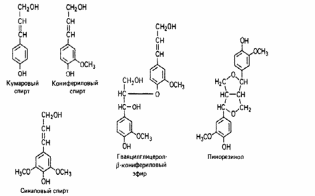
Лакказа была изучена еще в конце 19-го века. В 1883 году Hikorokuro Yoschida описал этот фермент в соке лакового дерева Rhus verniciferа, употребляемом в Японии для лакирования различных изделий. Через несколько лет, в 1886 году, Bertrand обнаружил лаккказу в грибах. Однако широкое изучение лакказ началось только в связи с рассмотрением их роли в деградации древесины дереворазрушающими грибами белой гнили, относящихся к классу Basidiomycetes. Наибольшее значение из них имеют грибы рода Tramete (Coriolus) (сем. Polyporaceae) [44]. Лакказа продуцируется грибами, растениями, насекомыми и бактериями. Считается, что в растениях лакказы участвуют в синтезе лигнина, катализируя реакцию полимеризации структурных единиц лигнина (таких как, n-кумаровый, конифериловый и синаповый спирты), которая протекает по свободно-радикальному механизму. Структурные единицы лигнина представлены на рисунке 1.
Рисунок 1―Структурные единицы лигнина
В насекомых фермент лакказа участвует в процессе склеротизации, а также играет важную роль при окислении токсичных соединений. Лакказоподобные белки, являющиеся представителями многоядерных медных белков, были описаны для разных видов бактерий (грамположительных и грамотрицательных) и есть данные о том, что эти белки вовлечены в синтез белка оболочки эндоспор [18]. Наиболее широко распространена лакказа среди грибов. Известно, что лакказу или лакказоподобные белки продуцируют фитопатогенные аскомицеты, представители которых относятся к родам Ophiostoma, Melanocarpus, Neurospora, Podospora, Monocillium, Gaeumannomyces и др., а также почвенные аскомицеты – Aspergillus, Curvularia, Penicilium; дереворазрушающие аскомицеты - Trichoderma, Bothryosphaeria, Xylaria [47]; эндофитные грибы Monotospora sp. и Cyathus bulleri [57]. Фенолоксидазная активность обнаружена у лихенизированных аскомицетов, принадлежащих к разным группам: эпигейные и эпифитные лишайники Peltigerales (лакказа и тирозиназа), Lecanorales (только лаккказа). Лакказа обнаружена в микоризных и сапротрофных грибах, таких как Agaricus [10], Armillariella mellea, Cerrena тахта, Cerrena unicolor, Chaetomium, Coprinus, Coriolopsis, Coriolus hirsutus, Coriolus maxima, Trametes galica, T. multicolor, T.ochracea [46]. Лакказа – это фермент, широко распространенный среди дереворазрушающих грибов. Присутствие этого фермента обнаружено у многих десятков видов базидиомицетов [7]. Среди физиологических групп грибов лакказа является типичной для дереворазрушающих базидиомицетов, разрушающих лигнин, так называемых грибов белой гнили Phanerochaete sordida и Phanerochaete chrysosporium [50], хотя идентифицирована она и в грибах бурой гнили Coniophora puteana, Laetiporus sulphureus. Фрагменты гена лакказы обнаружены в таких грибах как Amanita, Cortinarius, Hebeloma, Lactarius, Paxillus, Piloderma, Russula, Xerocomus Tylospora [41]. Основными физиологическими функциями грибных лакказ считаются участие в процессах деградации лигнина, окисление о -, м-, n- фенолов с различными заместителями, полифенолы, ароматические амины, развития морфогенеза грибов, в патогенезе, детоксикации, кроме того, предполагается, что грибная лакказа участвует в синтезе меланина, темного полимерного пигмента, который защищает микроорганизмы от отрицательного внешнего воздействия [43]. Многие авторы изучали возможность использовать биологические объекты для получения лакказы с целью последующего выделения или использования в составе культуральной жидкости. В качестве продуцента лакказы наиболее часто предлагают использовать такие виды Coriolopsis gallica, Coriolopsis polyzona, Pleurotus ostreatus, Pleurotus pulmonarius,Phlebia floridensis, Steccherinum ochraceum, Polyporus squamosus, Cerrena maxima, Funalia trogii и другиеи [41]. Для грибов рода Trametes (Т.versicolor) показано, что продукция внеклеточной лакказы составляет у них 95-98 % от общего количества внутри- и внеклеточных лакказ [46]. Лакказа продуцируется также и мицелиальными грибами рода Aspergillus, Fusarium, Penicillum, которые являются неотъемлемой частью биоценоза, участвующие в деградации лигнина растительного опада [11]. Данных об изучениях мицелиальных грибов, как потенциальных продуцентов лакказ, в литературе мало описано, но несмотря на это, известно, что микромицеты являются неотъемлемой частью биоценоза, продуцирующие окислительные ферменты, участвующие в деградации фенолсодержащих органических соединений. Разнообразное сочетание ферментативных комплексов у лигнинразрушающих грибов связано в первую очередь с экологическими особенностями грибов, трофической специализацией и является следствием длительной эволюции растений и грибов [26]. Представители различных таксономических и экологических групп обладают сходным составом ферментов. Однако уровень активности внеклеточных ферментов имеет существенную штаммовую и видовую вариабельность. По оксидоредуктазам отмечена вариабельность как среди штаммов одного вида, так и среди видов каждой группы [18]. В настоящее время во всем мире ведется интенсивная разработка технологий на основе базидиальных и мицелиальных лигнинолитических грибов и их ферментов как для обработки лигниноцеллюлозных материалов, так и для деградации фенолсодержащих органических соединений [1].
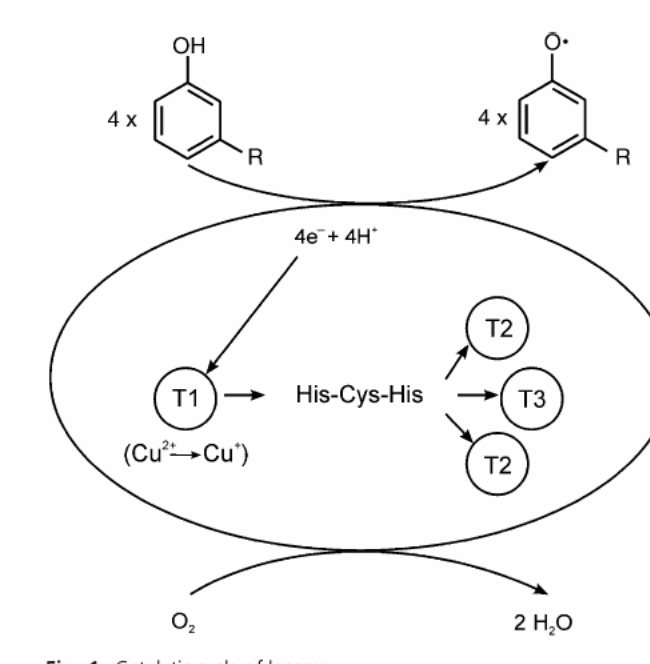
Лакказа катализирует окисление о- , м- , п- фенолов с различными заместителями, полифенолов, ароматических аминов, а также нефенольных соединений в присутствии медиаторов, восстанавливая кислород до воды согласно следующему уравнению: АН2+ ½ О2 + ЛАККАЗА → А+ Н2О [44]. Основными субстратами, по которым определяют активность лаказы являются: пирокатехин, гваякол, диаммониевая соль 2,2-азинобис-(3-этилбензотиазолин-6-сульфоновой кислоты (ABTS), сирингалдазин [42]. Схема окисления субстрата ( м- амещенного фенола) ферментом лакказой представлена на рисунке 2 [18]. С точки зрения строения лакказы микроорганизмов ―это гликопротеины, содержащие углеводные компоненты от 1 до 15% массы фермента, которая состоит из остатков маннозы и N- ацетилглюкозамина. Молекулярная масса лакказ составляет от 43 до 383 kDa, в среднем – 60 - 70 kDа. Изоэлектрическая точка около рН 4,0; рН - оптимум находится в области рН 3,0 –8,0 в зависимости от субстрата (для гидрохинона и пирокатехина он составляет 3,6-4,0 и 3,5-6,2 [ 41,48]. Лакказы дереворазрушающих грибов имеют низкую рН - оптимум окисления фенольных субстратов, совпадающим с оптимумом действия большинства грибных целлюлаз. Так, для лакказ Gaeumannomyces graminis var. Tritici, Coriolus histris он близок к рН 4, 5, а для лакказ других трутовиков Tramenas sanguenea, Poliporus pinsitus составляет рН 4,9 - 5,0 температурный оптимум 25 - 55° С [8].
Рисунок 2―Процесс окисления субстрата ферментом лакказой
Ключевыми характеристиками лакказ являются стандартные окислительно-восстановительные потенциалы трех медных центров фермента (ТІ, Т2 и ТЗ). Потенциал Т1 центра определен для многих лакказ и варьирует от 430 мВ до 780 мВ, в то время как потенциалы Т2 центра определены только для низкопотенциальной растительной лакказы R. vernisifera (390 мВ) и высокопотенциальной грибной лакказы T.hirsuta (400 мВ), а потенциал ТЗ центра для лакказ R. vernisifera (460 мВ) и Т. versicolor (785 мВ) [30,44]. Непосредственно лакказы окисляют только те соединения, потенциал ионизации которых не превышает редокс-потенциал иона меди ТІ центра фермента [51]. Исходя из потенциала Т1 центра все медьсодержащие оксидазы делят на три группы - высоко- , средне- и низкопотенциальные ферменты. К низкопотенциальным лакказам относят ферменты, потенциал Т1 центра которых ниже 430 мВ (Rhus vernicifera) [18], к среднередокспотенциальным – лакказы с потенциалами 470 - 710 мВ, а к высокопотенциальным – те, потенциал которых выше 710 Мв [31]. В традиционном понимании, лакказы представяют собой многоядерные медьсодержащие оксидазы, в литературе их относят к «голубым оксидазам. Типичные лакказы содержат 4 иона меди в активном центре. Ионы меди подразделяют на 3 типа: первый тип или голубая медь (Т1), которая придает ферменту характерный голубой цвет, выполняющая роль переносчика электрона от субстрата к трехъядерному «медному» кластеру к Т1 и Т2, представляющим собой биядерный медный кластер [30]. «Голубые» лакказы имеют характерную полосу поглощения, близкую к 610 нм. Однако описаны и другие лакказы, которые имели характерный желтый цвет и в его спектре поглащения отсутствовал максимум при 610 нм характерный для типичных синих лакказ. По этим свойствам такие ферменты отнесли к «желтым» лакказам, обнаруженных и описанных в базидиомицетах [11]. Лакказы могут окислять полициклические ароматические углеводороды и другие ароматические соединения. Низкомолекулярные агенты – медиаторы могут усилить лакказозависимую биодеградацию в результате образования высокореакционных радикалов. Так, лакказа разлагает на 40% 2,4-дихлорфенол в концентрации 1 ммоль/л за 12 часов [27]. Каталитические свойства фермента и его широкая субстратная специфичность, возможность использования в качестве субстрата акцептора электронов молекулярного кислорода, способность катализировать реакцию электровосстановления кислорода по безмедиаторному механизму и достаточно высокая стабильность обеспечивают широкое практическое применение лакказ в качестве наиболее часто используемыми окислителями природного происхождения в современных биотехнологиях очистки сточных вод от загрязнений биоцидами, красителями и другими ксенобиотиками [27]. Исходя из широких возможностей применения лакказ, данные ферменты определяют интерес исследователей, делая необходимым поиск и изучение новых эффективных микроорганизмов - продуцентов с целью создания на их основе биокатализаторов для процессов деструкции ксенобиотиков [1].
Лакказа содержит 4 иона меди в активном центре, и состоит из двух медьсодержащих центров (мономолекулярного «голубого» иона меди (Т 1- центр), координированного двумя остатками гистидина и одним остатком цистеина) и трехъядерного медного кластера Т2/Т3, который содержит один ион меди типа Т2, координированный двумя гистидинами, и два иона меди типа Т 3, координированные тремя остатками гистидина каждый [7]. Известно, что эффективность катализа у лакказ зависит от особенностей субстрата – донора электронов и окислительно-восстановительного потенциала (ОВП) медного центра (Т1) фермента. Следовательно, наибольший практический интерес представляют лакказы с высоким ОВП, поскольку они способны более эффективно разрушать лигнин и другие соединения как фенольной, так и нефенольной природы. Ионы меди в биологических системах классифицируют согласно их оптическим магнитным свойствам на три типа: T 1, Т 2 и Т3. В активном центре лакказы присутствуют все три типа, однако, несмотря на консервативность его строения, каталитические характеристики различных лакказ значительно отличаются, что, по мнению ряда авторов, определяется значением как окислительно-восстановительного потенциала иона меди первого типа, так и строением белковой и углеводной части фермента. В этой связи особый интерес для исследования представляет группа лакказ с высоким значением окислительно – восстановительного потенциала иона меди первого типа Т 1 [22].
Рисунок 3―Структуры каталитических центров Т1 и Т2/Т3 лакказы из C.hirsutus
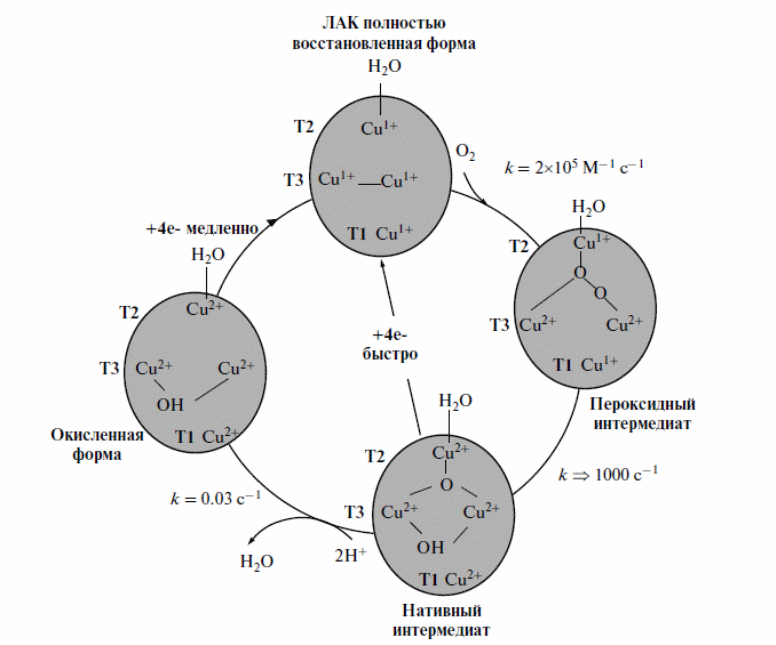
Структуры каталитических центров Т1 и Т2/ Т3 лакказы из C.hirsutus представлены на рисунке 3 [27]. Механизм катализа, представленный на рисунке 4, включает окисление субстрата – донора электронов и перенос электрона на Т1 центр фермента. После переноса 4 электронов с иона меди Т1 на кластер Т2/Т3 начинается последовательное восстановление всех трех ионов меди кластера, причем первым восстанавливается ион меди Т 3α, который имеет самое высокое сродство к электрону. Следующей стадией является восстановление Т2 центра. Ключевым шагом в этом процессе является образование “мостикового” гидроксила между Т2 и Т 3β, благодаря которому возможен быстрый электронный перенос на Т 2 центр. Следовательно, эта модель предполагает образование пары ионов меди смешанной валентности. Дальнейшее восстановление иона меди 3β постулируется как быстрый процесс переноса электрона по дипептиду цистеин–гистидин между Т1 и Т3 и сопровождается протонированием “мостикового” гидроксила с последующей диссоциацией двух молекул воды из кластера [18]. Эффективность катализа у лакказ зависит от окислительно-восстановительного потенциала иона меди Т1 (первичного акцептора электронов) и может быть обусловлена несколькими параметрами, главными из которых являются структура субстрат-связывающего кармана и состав формирующих его аминокислотных остатков, а также аминокислотного окружения иона меди Т1. Единого мнения по поводу того, какие же аминокислотные остатки могут оказывать существенное влияние как на величину ОВП, так и на эффективность связывания субстратов, все еще не существует [11]. Ион меди в центре Т1 непосредственно координируется двумя остатками His395 и His458 и остатком Cys453, которые являются строго консервативными у всех лакказ, как показано на рисунке 5 [18]. .
Рисунок 4 – Каталитический цикл окисления субстрата лакказой
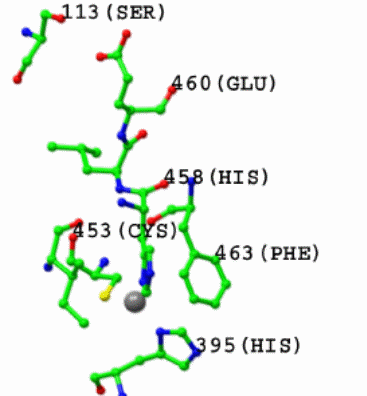
Кроме того, в ближайшую сферу окружения попадают также консервативный у всех лакказ остаток Ile455 и остаток Phe337 у высоко редокс-потенциальных лакказ (нумерация остатков по последовательности лакказы из C.hirsutus, который замещен на остаток лейцина у средне редокс-потенциальных лакказ и на остаток метионина у низко редокс-потенциальных). Аминокислотные остатки Phe337 (нумерация по последовательности лакказы C.hirsutus) и замещающий его остаток лейцина для высоко и средне редокс-потенциальных лакказ соответственно находятся на расстоянии превышающем 3,5Å от иона меди Т1 [46]. В настоящее время получены и опубликованы данные по структуре более 100 лакказ из различных источников [11]. Структурный анализ лакказ из различных источников позволил выдвинуть ряд гипотез, ни одна из которых пока не получила экспериментального подтверждения о взаимосвязи между структурой фермента и механизмом его действия. Несмотря на использование самых современных физико-химических методов, наличия большого количества данных по аминокислотной последовательности лакказ и структурных данных, пока не удается ответить на важные с практической и фундаментальной точки зрения вопросы о роли отдельных аминокислотных остатков, формирующих Т1 центр, и что обеспечивает широкую субстратную специфичность фермента на структурном и молекулярном уровнях [32].
Рисунок 5 – Взаимодействие Glu460 и Ser113 вблизи активного центра Т1 структуры C.hirsutus
Таким образом, изучена генетическая организация ряда лакказ и установлена структурно-функциональная особенность данных ферментов, что позволяет понять принципы организации и функционирования медьсодержащих оксидаз и использовать для создания рекомбинантных ферментов с точки зрения их биотехнологического применения [43].
Разнообразное сочетание ферментативных комплексов у лигнинразрушающих грибов связано в первую очередь с экологическими особенностями грибов, трофической специализацией и является следствием длительной эволюции растений и грибов. Представители различных таксономических и экологических групп обладают сходным составом ферментов. Однако уровень активности внеклеточных ферментов имеет существенную штаммовую и видовую вареабельность [32]. В неклеточные лигнолитические ферментные комплексы грибов белой гнили включают следующие типы окислительно-восстановительных ферментов: гемсодержащие ферменты, флавинсодержащие ферменты; целлобиозодегидрогеназа; медьсодержащие ферменты [28]. Помимо лигнинразрушающих ферментов эти грибы образуют также системы гидролаз, гемицеллюлозы и целлюлозу: 1) Гемсодержащие ферменты, среди которых принято особо выделять лигнинпероксидазы (ЛП) и марганецпероксидазы (МnП). Основная функция этих ферментов - прямое, как у ЛП или опосредованное медиатором (вератролом у ЛП и ионами Мn у МnП) одноэлектронное окисление ароматических субстратов до соответствующих радикалов и двухэлектронное восстановление перекиси водорода до воды. ―Лигнинпероксидаза – гемсодержащий фермент (диарилпропаноксигеназа, Н2О2-зависимая оксигеназа, лигниназа КФ 1.11.1.14) с молекулярной массой 39-42 кДа, являющийся донором Н202, и катализирующий одноэлектронное окисление различных соединений (предпочтительно нефенольных) за счет кислорода перекиси водорода, с восстановлением ее до воды [28]. Лигнинпероксидаза обнаружена лишь у немногих базидиальных грибов:Phanerochaete chrysosporium, Trametes versicolor, Trametes hirsuta, Panus tigrinus, Coriolopsis occidentalis [32]. ―Марганецпероксидаза – гемсодержащий фермент (КФ 1.11.1.3) с молекулярной массой 46 кДа, окисляющий фенольные соединения в присутствии перекиси водорода. Проявляет активность в среде, содержащей Мn. Марганецпероксидаза окисляет лигнин путем присоединения к нему не гидроксил-радикалов, а ионов Мn3+, которые при этом восстанавливаются до Мn. Регенерация Мn осуществляется сопряженной реакцией разложения перекиси водорода. При отсутствии в среде Н2О2 Мn-зависимая пероксидаза способна продуцировать пероксид водорода[28]. Мn -зависимая пероксидаза отмечена у таких грибов как Trametes versicolor, Phlebia radiate, Dischomitus squalens [32]. 2) Флавинсодержащие ферменты осуществляют в основном двух- электронное восстановление молекулы кислорода до перекиси водорода и одновременно двухэлектронное окисление ОН-группы, соответствующих субстратов, до карбонильных групп. Среди них - глюкозооксидазы, пиранозо-2-оксидазы, метанолоксидазы, арилалкогольоксидазы. ―Глюкозооксидаза катализирует окисление глюкозы, восстанавливая при этом кислород до перекиси водорода. Глюкозооксидаза выявлена у грибов Partus tigrinus, P.Chrysosporium [32]. ―Пиранозо-2-оксидаза - флавинсодержащая оксидаза с молекулярной массой 120 кДа, катализирует окисление низших первичных и ароматических спиртов до соответствующих альдегидов и пероксида водорода [27]. ―Арилалкогольоксидаза (вератрил-алкоголь оксидаза) - внеклеточная флавиноксидаза с молекулярной массой 72,5-78кДа; катализирует окисление ароматических спиртов до альдегидов, восстанавливая кислород до перекиси водорода [32]. ― Метанолоксидаза (МеО) - внеклеточный флавинсодержащий фермент с молекулярной массой 75кДа, катализирует окисление метанола до формальдегида, восстанавливая кислород до перекиси водорода. Выделена и охарактеризована у Phanerochaete chrysosporium, Trametes versicolor, Partus tigrinus [27]. 3) Целлобиозодегидрогеназа - флавин и гемсодержащая внеклеточная оксидоредуктаза грибов с молекулярной массой 90-97кДа, катализирует окисление целлобиозы до целлобионо-лактона, восстанавливая различные электронно-донорные субстраты (О2 до Н2О, Fe до Fe, Мn до Мn, хиноны до фенолов и др.) Целлобиозодегидрогеназа (ЦЦ) была выделена у Partus tigrinus, P. chrysosporiumи других грибов белой гиили, а также у грибов бурой и мягкой гнили древесины [28]. 4) К медьсодержащим ферментам относятся катехолоксидаза и лакказа катализируют включение кислорода в молекулу субстрата [52]. ―Катехолоксидаза участвует в гидроксилировании монофенолов до дифенолов и окислении дифенолов в ортохиноны. Она широко распространена среди микроорганизмов и имеет названия, соответствующие катализируемому субстрату: монофенолоксидаза, полифенолоксидаза, фенолаза, крезолаза, тирозиназа и др. ―Лакказа (п-дифенол: кислород оксидоредуктаза, КФ 1.10.3.2) относится к классу оксидаз; молекулярная масса лакказ составляет от 43 до 383 kDa, в среднем - 60-70 kDa; участвуюет в окислении фенолов с различными заместителями, ароматических аминов, восстанавливая молекулярный кислород до воды [55].
Интерес к практическому использованию лакказ возрос в середине 90-х годов ХХ века, после открытия возможности усиления действия этих ферментов с использованием различных редокс-медиаторов, что позволило существенно расширить область их практического применения. Медиаторы лакказ представляют собой субстраты этих ферментов, окисление органических соединений протекает по свободно-радикальному механизму, который в настоящее время до конца не изучен и, поэтом до сих пор остается неясным детальный механизм функционирования и принципы регуляции активности данного класса ферментов [31]. В течение ряда лет проводились интенсивные исследования лакказ на способность окислять широкий круг специфических органических и неорганических соединений. В 1990 г. была открыта возможность использования субстрата лакказ АБТС в качестве медиатора или усилителя действия лакказ. Было показано, что лакказа T.hirsuta в присутствии АБТС и ремазола голубого способна окислять нефенольные высоко редокс-потенциальные компоненты лигнина – вератровый спирт и 1-(3,4 - диметоксифенил)-2- (2- метоксифенокси) пропан-1,3- диол [56]. В идеальном случае, при отсутствии побочных реакций, редокс-медиатор фермента может осуществлять большое число циклов, не претерпевая при этом деструктивных превращений. Принцип действия лакказа - медиаторных систем отражен на рисунке 6 [56].
Рисунок 6―Лакказа-медиаторная система
Так же были исследованы окислительно-восстановительные свойства других медиаторов – гидроксибензотриазола, полиоксиметаллаты [SiW11V1O40]5- и т.д. К сожалению, в настоящее время нет соединений, полностью удовлетворяющих требованиям, предъявляемым к редокс-медиаторам лакказ. В первую очередь это связано с низкой стабильностью образующихся в процессе ферментативной реакции интермедиатов и, как следствие, низким числом редокс-циклов в процессе каталитического окисления нефенольных соединений [58]. К усилителям можно отнести как истинные редокс - медиаторы лакказ, которые не расходуются в процессе многократных циклических превращений и продукты ферментативного окисления которых имеют высокий редокс-потенциал, так и соединения, в процессе окисления которых образуется активный радикал, способный к дальнейшим превращениям. Описано только небольшое число соединений, которые хотя и не являются "идеальными" (истинными) редокс - медиаторами, но могут осуществлять значительное число редокс-циклов [45]. В последние годы появилось большое количество публикаций, посвященных поиску и исследованию механизма функционирования новых усилителей действия лакказ, которые, во-первых, нетоксичны и, во- вторых, имеют низкую стоимость и высокую эффективность. Подавляющее большинство из них не являются истинными редокс - медиаторами, так как после одного или нескольких циклов выходят из реакционного процесса в результате вторичных химических превращений. Наиболее часто в качествередокс-медиаторов используются соединения, в состав которых входят структурные группы N-OH и N-O. К этим соединениям относится виолуровая кислота и N- гидроксиацетанилид [32]. Была предложена схема отбора потенциальных медиаторов лакказ и экспериментальные методы их тестирования, включающая 4 стадии [56]: ― Отбор соединений на основе анализа структурной формулы с учетом необходимости наличия сопряженных связей и гетероциклических атомов, а также ОН - и NH2- гpyпп; ― Определение каталитических характеристик отобранных соединений в гомогенных ферментативных реакциях, катализируемых лакказой; ― Анализ циклических вольтамперограмм растворов отобранных соединений в отсутствии и в присутствии модельных соединений лигнина; ― Прямой эксперимент по анализу продуктов окисления модельного соединения лигнина системой медиатор - лакказа. С помощью предложенной схемы найден новый класс соединений (потенциальных медиаторов лакказ) с общим названием 1-фенил-3-метил-пиразолоны-5. Эти соединения относятся к гетероциклическим соединениям, содержащим в своем составе два заместителя электрон-донорной природы - метильную и фенильную группы, и присутствуют в растворе в виде двух таутомерных формах. Показано, что при электрохимическом и ферментативном окислении этих соединений образуются высокопотенциальные промежуточные соединения, способные окислять модельное соединение лигнина – вератровый спирт [31]. Контрольные эксперименты показали, что в отсутствии лакказы исследуемые медиаторы практически не способны к окислению вератрового спирта, а лакказа в отсутствии медиаторов окисляет менее 2% вератрового спирта [42].
Известны способы получения очищенных препаратов лакказы [34], и в составе других ферментных препаратов [33]. Однако они сложны, многоэтапны, так как включают в себя комбинацию разных методов очистки: высаливание, многоступенчатая хроматография на различных носителях и требуют для своего исполнения сложного и дорогостоящего аппаратурного и реактивного обеспечения. Например, оптимизированная схема очистки включает следующие стадии [29]: 1) Получение исходного ферментного препарата. Культуральная жидкость (КЖ) отделяют от мицелия фильтрованием, затем концентрируют ультрафильтрацией на полых волокнах с помощью разделительного аппарата. 2) Белки КЖ осаждают (NH4)2SO4 при 90% от насыщения. Осадок растворяют в буфере А, диализуют против буфера. 3) Анионообменную хроматографию проводят на колонке с ДЭАЭ-сефацелем, уравновешенную буфером А. Элюируют белок градиентом 0 - 1М NaCl в буфере А, скорость элюции 1 мл/мин, фракции по 5 мл. Фракции с активностью лакказы объединяют, диализуют против 1М (NH4)2SO4 в буфере А. Применение ДЭАЭ-сефацеля позволяет отделить фермент от пигмента, присутствие которого нежелательно из-за его необратимой адсорбции на носителях при последующих стадиях хроматографии. 4) Диализованный препарат наносят на колонку с Phenyl-Sepharose, уравновешенную 1 М (NH4)2SO4 в буфере А. Гидрофобная хроматография на колонках с фенил-сефарозой позволяет получить гомогенный белок .Белки элюируют градиентом 1 - 0 М (NH4)2SO4 в буфере А со скоростью 1 мл/мин, объем фракций 5 мл. Активные фракции объединяют, диализируют против буфера В. 5) Анионообменная хроматография на MonoQ5/50 GL. Препарат наносят на колонку, предварительно уравновешенную буфером В. Скорость нанесения 0,5 мл/мин. Связавшиеся белки элюируют линейным градиентом 0 - 0,5 М NaCl в буфере В. Скорость элюции 0,5 мл/мин, объем фракций 1 мл. 6) Разделение изоформ достигается в ходе проведения изоэлектрофокусирования препаративной (ИЭФ) в слое гранулированного геля Sephadex IEF. Две четкие зоны геля Sephadex, содержащие изоформы лакказы, собирают по отдельности. Sephadex из каждой зоны переносят в колонки 130 х 25 мм, суспендируют в буфере В , давая осесть гелю, а затем элюируют лакказу примерно четырьмя - пятью объемами буфера В по отношению к объему исходного геля Sephadex. Гомогенность каждого препарата проверяют с помощью SDS-электрофореза. Полученный препарат лакказы концентрируют с помощью микроконцентратора Vivaspin 2. 7) Удаление амфолинов из препарата фермента проводят в ходе гельфильтрации на Superdex 200, уравновешенной буфером В. Элюируют лакказу тем же буфером, скорость элюции 0,8 мл/мин, объём фракций 1 мл. Полученные активные фракции объединяют, концентрируют с помощью микроконцентраторов Vivaspin 2. Гомогенность полученного препарата проверяется электрофоретически, а также идентичностью N-концевых аминокислотных последовательностей очищенных белков.
Основной трудностью в работе с лакказами является то, что затруднительно определять лакказу по воздействию на субстрат, ввиду ее очень широкой субстратной специфичности, которая варьирует от одной лакказы к другой, а спектр субстратов перекрывается со спектром субстратов тирозиназы. Хотя лакказу называют дифенолоксидазой, монофенолы, такие, как 2,6-диметоксифенол или гваякол, часто оказываются лучшими субстратами для лакказы, чем дифенолы, такие как пирокатехин или гидрохинон [47]. Некоторые авторы, ссылаясь на работу [53], рассматривают сирингалдазин как исключительный субстрат лакказы в условиях, когда пероксид водорода, способный также окислять сирингалдазин, устранен из сферы реакции. Лакказа окисляет также полифенолы, метокси-замещенные фенолы и ароматические диамины, но не окисляет тирозин, как это делает тирозиназа [49]. Одним из примеров использования лакказа-медиаторной системы является делигнификация и обесцвечивание бумажной пульпы, вторичной переработки макулатуры и детоксикация промышленных отходов. Принцип функционирования таких систем состоит в ферментативном окислении медиаторов лакказ с образованием продуктов с высокими редокс - потенциалами. Последние могут взаимодействовать с карбогидратами, лигнином или другими экотоксикантами (красители, пестициды и др.) и проводить их деструкцию [35]. Препараты грибных лакказ и их иммобилизованные формы эффективны при очистке сточных вод гидролизно-дрожжевого производства, содержащих фенольные соединения, при удалении лигнинсодержащих примесей в обработке текстиля [16]. Лакказы широко используются в текстильной промышленности для обработки льна, обесцвечивания и окрашивания хлопковых тканей [33, 35, 39]; известно использование лакказы в косметической промышленности в качестве агента для окрашивания волос [33, 34, 36, 40]; для производства отбеливающей зубной пасты, в производстве моющих средств [37]; в иммуноферментном анализе в качестве фермента-маркера [25, 26, 35]. В пищевой промышленности лакказа используется при изготовлении драже и жевательной резинки, освежающей дыхание. Хиноны, образующиеся в процессе реакции, связываются со специфическими соединениями серы, которые обусловливают неприятный запах изо рта. В редких случаях фермент используют при изготовлении пива для предотвращения появления посторонних запахов [37]. При изготовлении белого виноградного вина использование лакказы способствует удалению фенолов. Лакказа также используется для определения антиоксидантной активности красных вин [18]. Добавление лакказы в состав чая, кофе, какао способствует более интенсивному окрашиванию напитков в коричневый цвет. В настоящее время для получения лакказы используют генетически модифицированные микроорганизмы Aspergillus oryzae и Trichoderma viridae [24]. В современных условиях, когда особое значение приобретает проблема охраны окружающей среды, большое внимание уделяется способности дереворазрушающих грибов разрушать такие вещества как 2,3,7,8- тетрахлоробензо-п-диоксин, линдан и бензопирен [45]. Лакказы-очень эффективные агенты, используемые для биодеградация ксенобиотиков [35], в том числе фенольных отходов [36], 2,4- дихлорфенола и пентахлорфенола, гербицидов (атразина) [56,58]; для создания антимикробных композиций [39]. Активные ферментные комплексы дереворазрушающих грибов могут быть использованы в промышленности для обесцвечивания сточных вод. Лакказу применяют в биосенсорах, для анализа фенольных соединений [27]. Показана возможность использования лакказы Coriolus versicolor для определения фенолов [17] включая лигнины, в сточных водах промышленных предприятий [40]. Таким образом, актуальной задачей биотехнологии является разработка технологий производства ферментного препарата лакказы. Однако в настоящее время недостаточно изучены вопросы влияния компонентов питательной среды и условий культивирования на синтез лакказы в условиях глубинного культивирования. Важнейшими этапами разработки технологии является разработка стадии культивирования и, в частности: выбор высокопродуктивного штамма, выбор основного сырья и дополнительных компонентов, оптимизация количественного состава питательной среды, оптимизация условий культивирования и разработка технологии выделения.
Лигнин (от лат. lignum — дерево, древесина)―сложное полимерное соединение, содержащееся в клетках сосудистых растений. Относится к инкрустирующим веществам оболочки растительной клетки. Отложение лигнина в клеточных оболочках вызывает одревеснение клеток и увеличивает их прочность [7]. Древесина лиственных пород содержит 18-25 % лигнина, хвойных - 23-50 %, в соломе злаков 12 - 20 % от массы; у низших растений (водоросли, грибы) и мхов лигнин не обнаружен. Одревесневшие клеточные оболочки обладают ультраструктурой, которую можно сравнить со структурой железобетона [11]. В химическом отношении лигнин неоднороден. Он представляет собой весьма сложное соединение, субъединицы лигнина―это производные фенилпропана, главным образом конифериловый спирт у хвойных пород, лигнин лиственных пород содержит конифериловый и синаповый спирты, а лигнин злаков-еще и кумаровыи спирт. Эти различия отражаются прежде всего в содержании метоксильных групп: в лигнине лиственных пород оно варьирует в пределах от 20,5 до 21,5%, в лигнине хвойных - от 15 до 16%, а в лигнине злаков - от 14 до 15% [14]. Сложность строения лигнина обусловлена разнообразием связей, при помощи которых мономерные блоки соединены друг с другом. Такое нерегулярное строение согласуется с представлением о том, что при синтезе лигнина ферменты участвуют лишь в образовании радикалов кониферилового спирта; эти радикалы уже спонтанно вступают затем в различные связи, причем характер возникающих связей определяется мезомерным состоянием радикалов [11]. Фенилпропаноидные единицы в молекуле лигнина различным образом соединены между собой при помощи эфирных и углерод - углеродных связей. На рисунке 8 представлены фенилпропаноидные единицы лигнина [20]. При действии кислот в лигнине могут гидролизоваться углерод-кислородные связи, но сохраняются существующие в нем углерод - углеродные связи и образуются новые. Эти связи чрезвычайно устойчивы к действию ферментов [12].
Рисунок 7―Исходные вещества для биосинтеза лигнина (слева) и димеры кониферолового спирта, образующиеся как промежуточный продукт при синтезе и распаде лигнина
Грибы, разрушающие древесину, а также почвенные грибы и бактерии разлагают лигнин гораздо медленнее, чем целлюлозу и гемицеллюлозы. Некоторые грибы могут разрушать лигнин даже в живых растениях [11]. Известно, что биодеградация лигнина имеет выраженный окислительный характер. Она происходит в боковых цепях, которые окисляются с образованием карбонильных и α -карбоксильных групп, и в ароматическом ядре, которое окисляется в результате деметилирования и введения гидроксильных групп в фенольные остатки с образованием 2,3- и (или) 3,4-дигидроксифенильных остатков [53]. Различные структуры лигнина деградируются внеклеточными ферментами дереворазрушающих, которые атакуют низкомолекулярные и полимерные субстраты [20]. Базидиомицеты, разрушающие древесину можно разделить на две группы: - Возбудители бурой гнили превращают древесину в красновато-коричневую массу; они разрушают главным образом целлюлозные и гемицеллюлозные компоненты древесины и не действуют на фенилпропановые полимеры. -Возбудители белой гнили разрушают древесину с образованием почти белой массы; они действуют в первую очередь на лигнин и почти не затрагивают целлюлозу [44]: К грибам, разрушающим лигнин, относятся Polystictus versicolor и некоторые другие (например, Stereum hirsutum). Есть также грибы, действующие одновременно на лигнин и целлюлозу; таковы Pleurotus ostreatus,Ganoderma applanatum,Polyporus adustus, Armillaria Mellea [53].
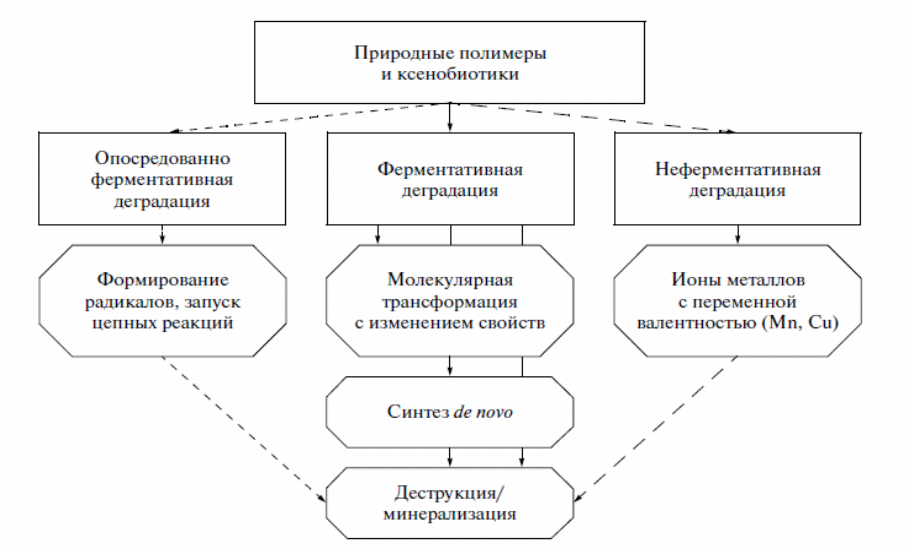
Разложение персистентных ксенобиотиков, в том числе суперэкотоксикантов (диоксинов), представляет собой серьезную экологическую проблему, так как они обнаруживаются в почвах и грунтовых водах через многие годы после завершения применения [45]. Способность грибов к деградации ксенобиотиков ароматической природы связана с их приспособленнностью к трансформации лигнина - сетчатого фенилпропаноидного полимера нерегулярного строения, который является основным неуглеводным компонентом растительного опада. Основные пути разложения природных полимеров и ксенобиотиков грибами представлены на схеме 8 [42]. Наименее изучены механизмы разложения ксенобиотиков ароматической природы почвенными мицелиальными грибами. Между тем, именно они, наряду с бактериями, составляют основную массу обитателей почв и перерабатывают большую часть лигнина, поступающего в почву [20]. У почвенных грибов ключевую роль в разложении ароматических ксенобиотиков отводят лакказам, способным конденсировать их с низкомолекулярными предшественниками гуминовых кислот или фульфокислот [18]. Результатом является частичная минерализация, а также образование гумусовых веществ. У бактерий разложение ксенобиотиков ароматической природы может обеспечиваться, например, системой ферментов, включающей катехол-1,2-диоксигеназы, муконатциклоизомеразы, диенлактон-гидролазы и муконолактон-изомеразы [53].
Рисунок 8―Основные пути разложения природных полимеров и ксенобиотиков грибами
Способность грибных лакказ обесцвечивать различные красители, присутствующие в сточных водах текстильной промышленности, хорошо изучена [43, 48, 74,83]. Суммируя существующие данные, можно сказать, что обесцвечивание красителей лакказой базидиальных грибов показано для 31 вида и 77 красителей и их смесей. При этом среди исследованных базидиальных грибов роды Phanerochaete и Trametes охарактеризованы наиболее подробно, как способные к разложению широкого класса красителей. Однако запатентованным в настоящее время является только препарат на основе Flavodon flavus [84], что свидетельствует о необходимости дальнейшего изучения базидиальных грибов, родов Phanerochaete и Trametes, которые могут быть использованы для биоремедиации сточных вод текстильной промышленности [18]. Биологическая очистка вод от радионуклидов и тяжелых металлов с помощью грибов основана на их способности интенсивно поглощать токсиканты. При этом поглощение металлов грибами может происходить не только вследствие адсорбционных процессов, как в случае бактерий, но также и благодаря активному транспорту металлов в клетки [35]. Эта уникальная способность грибов делает их в ряде случаев оптимальными агентами биологической очистки от металлов и радионуклидов. В качестве грибов, способных к интенсивному поглощению радионуклидов и тяжелых металлов, рекомендовали аскомицеты Aspergillus, Penicillium и Phizopus [42]. В последнее время, однако, все большее внимание уделяется изучению в качестве потенциальных биосорбентов базидиальных грибов, что объясняется, по-видимому, их меньшей патогенностью. Высокие концентрации тяжелых металлов в среде токсичны для базидиальных грибов, поэтому при выборе штамма необходимо исследование чувствительности конкретного вида гриба. Согласно данным, полученным в работе [56], высокой устойчивостью к металлам обладают Pleurotus ostreatus, P. cystidosus, Stereum hirsutum устойчивы к кадмию и ртути и Trametes versicolor (устойчив к Cd, Zn, Ni, Co, Cr, Mo, Pb, Hg, Sn).Способностью аккумулировать наиболее широкий спектр тяжелых металлов обладают грибы родов Pleurotus, Trametes и Phanerochete, что делает представителей этих родов наиболее перспективными с точки зрения использования в технологиях биологической очистки сточных вод от тяжелых металлов [44]. В классической схеме очистки от нефти и нефтепродуктов биологические методы использовали только на завершающей стадии очистных мероприятий, однако сейчас отмечается тенденция к замене многостадийных схем очистки на одностадийные [18]. В основе разрабатываемых подходов лежит использование консорциумов микроорганизмов, к которым относятся представители мицелиальных грибов, дрожжей и бактерий, эффективно трансформирующих компоненты нефти в нетоксичные и малотоксичные вещества. При этом очистка нефтезагрязненных сред в in situ может осуществляться как с помощью поддержания и стимулирования естественной нефтеокисляющей микрофлоры путем создания оптимальных условий для ее развития (аэрация, внесение в очаг загрязнения азотнофосфорных удобрений), так и введением активного штамма деструктора в место загрязнения [56]. Для очистки водной поверхности от нефтяных загрязнений в нашей стране разработан комплексный микросорбент, содержащий штаммы грибов аскомицетов Fusarium solani, F. moniliforme, Trichoderma harzianum и Cladosporium resinae [22]. Указанные грибы иммобилизуют на гидрофобных носителях и используют в качестве сорбентов и деструкторов нефти [22]. Для очистки почвы и водных поверхностей от нефти и нефтепродуктов разработан и применяется комплексный препарат, содержащий как грибы класса аскомицеты (Aspergillus niger), так и базидиомицеты (Phanerochaete chrysosporium), предназначенный для распыления по водной поверхности в смеси с детергентами и сорбентами [46]. Аналогичные препараты, содержащие штамм Phanerochaete chrysosporium и предназначенные для очистки сред, загрязненных нефтяными углеводородами, зарегистрированы в США [37]. Для очистки почв от нефтяных загрязнений применяют биопрепараты, содержащие в своем составе, главным образом, бактерии, такие как Pseudomonas,Rhodococcus, Bacillus, Arthrobacter, Acinetobacter, Azotobacter, Alkaligenes, Mycobacterium, а также дрожжи Candida и нитевидные актиномицеты Streptomyces. В препаратах грибного происхождения используются преимущественно аскомицеты родов Aspergillus и Penicillium [53], а среди базидиальных грибов высокая нефтедеструктивная способность показана только для родов Phanerochaete, Pleurotus и Trametes. В присутствии P.chrysosporium, P. ostreatus и T. (Coriolus) versicolor через 12 месяцев после инокуляции количество нефтяных углеводородов снижалось на 68.7, 53.1 и 78.1%, соответственно [44]. Особенностью биоразложения нефтяных углеводородов грибами является их способность метаболизировать ароматическую фракцию ароматических углеводородов, тогда как бактерии разрушают преимущественно парафинонафтеновые углеводороды [49]. Патентов, содержащих описание препаратов на основе базидиальных грибов и предназначенных для очистки почв, загрязненной нефтью, в РФ нет. В США зарегистрирован единственный патент, содержащий описание способа очистки нефтезагрязненных сред с использованием P. chrysosporium [40]. Наряду с разложением природных полимеров (лигнин, целлюлоза, гуминовые вещества), в литературе встречаются данные о способности базидиальных грибов разлагать синтетические полимеры. Синтетические полимеры (пластмассы) широко используются в современном мире. Вследствие их чрезвычайной устойчивости и постоянное накопление в окружающей среде актуален поиск путей биодеградации [49]. Выраженная деполимеризация, регистрируемая по уменьшению количества C–H связей, была продемонстрирована для P. chrysosporium, P. sajor caju, и Polyporus versicolor; наименьший деполимеризационный потенциал был отмечен для видов, принадлежащих к роду Pleurotus. Согласно данным [45], гриб Pycnoporus cinnabarinus обладал способностью к разложению другого синтетического полимера – поливинилового спирта – применяемого в качестве клея. Авторами был показана взаимосвязь разложения полимера с продукцией лакказы. Для грибов P. chrysosporium и Trametes versicolor была продемонстрирована способность разлагать такой полимер как нейлон, широко используемый в текстильной промышленности [49]. Позднее выделение и характеристика фермента, ответственного за разложение полимера, показали его сходство с MnП [53].Была показана способность базидиальных грибов разлагать остатки резиновых покрышек. Было установлено, что наиболее эффективным, по-видимому, является Resinicium bicolor. При обработке используемых в качестве добавок к резине ароматических соединений Resinicium bicolor было отмечено усиление роста на резине бактерий Thiobacillus ferrooxidans, а также ускорение процессов девулканизации [54]. Таким образом, использование грибов и их окислительных ферментов, в том числе лакказ, в технологиях переработки и утилизации техногенных образований и отходов возможно по следующим основным направлениям: - очистка загрязненных вод (в том числе сточные воды текстильной промышленности и ЦБК; воды, загрязненных нефтяными углеводородами [11]; -сточные воды, образующиеся при производстве оливкового масла; жидкие отходы, образую щиеся при производстве сахара из сахарной свеклы или сахарного тростника [22,42]; -водной суспензии, остающейся после коагуляции латекса припроизводстве резины [54]; -сточные воды, содержащие тяжелые металлы и радионуклиды [35,42]; –очистка загрязненных почв, в том числе, загрязненных ксенобиотиками и, тяжелыми металлами [44]; – разложение труднодеградируемых субстратов, в том числе лигнин и лигнинцеллюлозных отходов, низкоэнергетических углей и синтетических полимеров [20,22,49]. Таким образом, задачей биотехнологии является разработка технологий производства ферментного препарата лакказы, так как применение препаратов лакказ перспективно во многих областях промышленности: целлюлозо-бумажной (делигнификации бумажной пульпы); текстильной (экологически чистое отбеливание тканей); тонком органическом синтезе (например, синтез электропроводящих полимеров); пищевой (удаление следов кислорода в продуктах питания для увеличения срока хранения); косметической (краска для волос, отбеливающая зубная паста); производстве моющих средств (отбеливающий агент); для биодеградации ксенобиотиков, в том числе отравляющих веществ; синтезе лекарственных препаратов (например, антибиотиков); в биосенсорах (например, анализ фенольных соединений, включая лигнины, в сточных водах промышленных предприятий) определение антиоксидантного статуса продуктов [36, 45, 49]. Благодаря очень широкой субстратной специфичности использование грибных лакказ для деградации лигноцеллюлозных материалов и ксенобиотиков очень перспективна и актуальна, поэтому ведутся интенсивные работы в области разработки подходов к деградации ксенобиотиков и лигноцеллюлозных материалов, получению рекомбинантных штаммов продуцентов этих ферментов и увеличению эффективности катализа, рН и термостабильности [29].
|