
- •Процессы с рабочими телами
- •Термические параметры………………………………………………………………..6
- •Диаграмма ……………………………………………………………………….15
- •Диаграмма ……………………………………………………………………….16
- •§ 1. Определение параметров в начальном состоянии (в точке 1)
- •Калорические параметры ( )
- •§ 2. Определение параметров в конечном состоянии (в точке 2)
- •Термические параметры ( )
- •Калорические параметры ( )
- •§ 3. Изменение калорических параметров в процессе
- •§ 4. Определение характеристик процесса ( , , , , , )
- •2. Определение параметров в конечном состоянии (в точке 2)
- •3. Изменение калорических параметров в процессе
- •4. Характеристики процесса
- •§ 2. Определение параметров в начальном и конечном состояниях по энтропийным диаграммам
- •2.1. Диаграмма
- •2.2. Диаграмма
- •§ 3. Сопоставление параметров, найденных по таблицам и диаграммам
§ 3. Изменение калорических параметров в процессе
Вычисление изменения калорических параметров по приближённым формулам (случай
 )
)
Изменение удельной энтальпии
 ,
начало отсчёта
;
,
начало отсчёта
;  ,
начало отсчёта
; (Проверка:
,
начало отсчёта
; (Проверка:
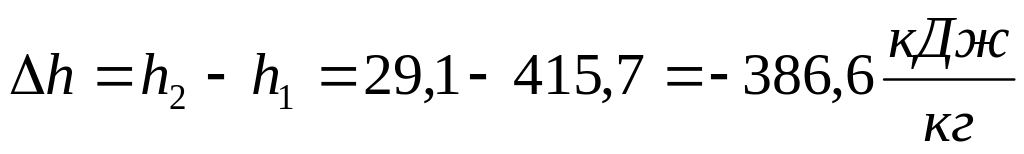 ,
начало отсчёта
;
,
начало отсчёта
;  ,
начало отсчёта
);
,
начало отсчёта
);Изменение удельной внутренней энергии
 ,
начало отсчёта
;
,
начало отсчёта
;  ,
начало отсчёта
; (Проверка:
,
начало отсчёта
; (Проверка:
 ,
начало отсчёта
;
,
начало отсчёта
;  ,
начало отсчёта
);
,
начало отсчёта
);
Из пунктов 1 и 2 мы видим, что изменение параметров не зависит от начала отсчёта и шкалы, по которой мы измеряем температуру (Цельсия или Кельвина).
Изменение удельной энтропии
 , (Проверка:
, (Проверка:
 ).
).
Так как изменения калорических параметров вычисляются по приближённым формулам, то значения получены неточно.
В полных величинах:
![]() ;
;
![]() ;
;
![]() .
.
Вычисление изменения калорических параметров по уточнённым формулам (случай
 )
)
Пользуясь значениями, полученными из таблиц «Термодинамические свойства газов» (Ривкин С.Л.) для водяного пара ( ) как идеального газа, находим:
Изменение удельной энтальпии
 ;
;Изменение удельной внутренней энергии
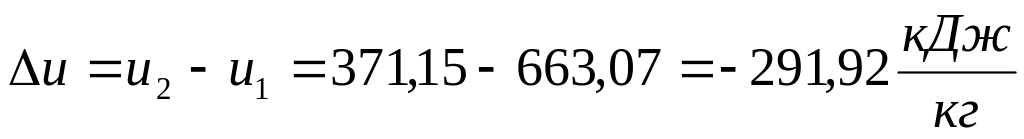 ;
;
Изменение удельной энтропии
![]() (Проверка:
(Проверка:
![]() ).
).
В полных величинах:
 ;
; ;
; .
.
Пользуясь значениями, полученными из таблиц средних теплоёмкостей для водяного пара ( ) как идеального газа,
 мы
не можем определить изменения калорических
параметров т.к.
мы
не можем определить изменения калорических
параметров т.к.

§ 4. Определение характеристик процесса ( , , , , , )
В процессе
 тело не отдает и не получает теплоты
из внешней среды :
тело не отдает и не получает теплоты
из внешней среды :
![]()
4.1.1. Случай (по молекулярно-кинетической теории):
Для адиабатного процесса деформационная
работа (![]() )
и работа перемещения (
)
и работа перемещения (![]() )
связаны с понятием теплоемкости. Запишем
эти зависимости:
)
связаны с понятием теплоемкости. Запишем
эти зависимости:
![]() кДж/кг
кДж/кг
![]() кДж/кг
кДж/кг
![]() кДж/кг
кДж/кг
![]() кДж/кг
кДж/кг
Выведем формулы для вычисления деформационной работы и работы перемещения:
1) Из уравнения энергобаланса для закрытых систем через деформационную работу в удельных величинах:
![]() ,
,
![]() =>
=>
![]()
![]() кДж/кг
кДж/кг
в полных величинах :
![]() МДж
МДж
2) Из уравнения энергобаланса для закрытых систем через работу перемещения в удельных величинах:
![]() ,
=>
,
=>
![]()
![]() кДж/кг
кДж/кг
в полных величинах
![]() МДж
МДж
4.1.2. Случай (по квантово-статистической теории):
1)Из уравнения энергобаланса для закрытых систем через деформационную работу вычисляем по формуле:
![]() кДж/кг
кДж/кг
в полных величинах :
![]() МДж
МДж
2) Из уравнения энергобаланса для закрытых систем через работу перемещения в удельных величинах :
, q=0 =>
Удельную работу перемещения вычисляем по формуле :
![]() кДж/кг
кДж/кг
в полных величинах :
![]()

 МДж
МДж
Q=0 ΔU
Схема энергобаланса:
У меньшение
внутренней энергии РТ
меньшение
внутренней энергии РТ
идет на выполнение работы L
L
 §
5. Изображение процесса в
и
диаграммах
§
5. Изображение процесса в
и
диаграммах
5.1. диаграмма

5.2. диаграмма

ЧАСТЬ №2
Расчёт в предположении, что водяной пар – реальный газ
§ 1. Определение параметров в начальном и конечном состояниях с помощью таблиц водяного пара
 1.
Определение параметров в начальном
состоянии (в точке 1)
1.
Определение параметров в начальном
состоянии (в точке 1)
По условию задачи в точке 1
заданы два независимых термических
параметра: абсолютное давление (![]() )
и удельный объём (
)
и удельный объём (![]() ,
,
![]() ).
Эти данные позволяют найти все остальные.
).
Эти данные позволяют найти все остальные.
С целью определения состояния реального
газа по давлению
![]() в таблице №2 находим температуру
насыщения (
в таблице №2 находим температуру
насыщения (![]() ).
Так как t1>ts(P1),
то данное состояние реального газа –
перегретый пар. Его параметры находим
по таблице №3:
).
Так как t1>ts(P1),
то данное состояние реального газа –
перегретый пар. Его параметры находим
по таблице №3:
– удельный объем ![]()
– удельная энтальпия .![]() ;
;
– удельная энтропия .![]() ;
;
Удельную внутреннюю энергию рассчитываем по формуле:
![]() .
.
