
- •Термические параметры………………………………………………………………..6
- •Калорические параметры ( )
- •§ 2. Определение параметров в конечном состоянии (в точке 2)
- •Термические параметры ( )
- •Калорические параметры ( )
- •§ 3. Изменение калорических параметров в процессе
- •§ 4. Определение характеристик процесса ( , , , , , )
- •2. Определение параметров в конечном состоянии (в точке 2)
- •2.2. Диаграмма
- •§ 3. Сопоставление параметров, найденных по таблицам и диаграммам
Министерство образования Украины
Национальный Технический Университет Украины
«Киевский Политехнический Институт»
Кафедра теоретической и промышленной теплотехники
Процессы с рабочими телами
Пояснительная записка к расчетной работе
по предмету
«Техническая термодинамика»
Выполнил:
студентка 2 курса
ТЭФ, гр. ТП-42
Приступа Роман
Проверил:
Трокоз Я.Е.
Киев-2005
Содержание задания
 V1=4
м3 водяного пара при давлении
V1=4
м3 водяного пара при давлении
![]() и температуре t1=330°C
совершают изохорный процесс до давления
P2=30 бар. Определить
все начальные и конечные параметры
рабочего тела, работу и количество тепла
в процессе. Как изменятся результаты
расчёта, если при тех же исходных данных
этот процесс совершается с идеальным
газом
и температуре t1=330°C
совершают изохорный процесс до давления
P2=30 бар. Определить
все начальные и конечные параметры
рабочего тела, работу и количество тепла
в процессе. Как изменятся результаты
расчёта, если при тех же исходных данных
этот процесс совершается с идеальным
газом
![]() при теплоёмкости, зависящей от температуры?
при теплоёмкости, зависящей от температуры?
V1=4 м3
P2=30 бар t1=330°C v=const |
|
 Содержание
Содержание
Часть №1
Расчёт в предположении, что водяной пар – идеальный газ
Определение параметров в начальном состоянии…………………………………………4
Термические параметры………………………………………………………………..4
Калорические параметры……………………………………………………………….4
Определение параметров в конечном состоянии………………………………………….6
Термические параметры………………………………………………………………..6
Калорические параметры……………………………………………………………….6
Изменение калорических параметров в процессе…………………………………………8
Вычисление изменения калорических параметров по приближённым формулам…8
Вычисление изменения калорических параметров по уточнённым формулам…….8
Определение характеристик процесса…………………………………………………….10
Изображение процесса в
 и
и
 диаграммах……………………………………..11
диаграммах……………………………………..11
Часть №2
Расчёт в предположении, что водяной пар – реальный газ
Определение параметров в начальном и конечном состояниях с помощью таблиц водяного пара………………………………………………………………………………12
Определение параметров в начальном состоянии (в точке 1)……………………...12
Определение параметров в конечном состоянии (в точке 2)……………………….12
Изменение калорических параметров в процессе …………………………………..13
Характеристики процесса……………………………………………………………..13
Определение параметров в начальном и конечном состояниях по энтропийным диаграммам………………………………………………………………………………….14
Диаграмма
 ……………………………………………………………………….14
……………………………………………………………………….14Диаграмма
 ……………………………………………………………………….15
……………………………………………………………………….15Диаграмма
 ……………………………………………………………………….16
……………………………………………………………………….16
Сопоставление параметров, найденных по таблицам и диаграммам…………………...17
Заключение………………………………………………………………………………….18
ЧАСТЬ №1
Расчёт в предположении, что водяной пар – реальный газ
§ 1. Определение параметров в начальном состоянии (в точке 1)
Термические параметры (
 )
)
По условию задачи в точке 1 заданы два
независимых термических параметра:
абсолютное давление (![]() )
и удельный объём (
)
и удельный объём (![]() ).
).
Третий термический параметр –
термодинамическую температуру –
вычисляем из термического уравнения
состояния идеального газа
![]() :
:
![]() .
.
В этом уравнении удельная (индивидуальная) газовая постоянная вычисляется по зависимости
![]() ,
,
где
![]() – молярная (универсальная ) газовая
постоянная;
– молярная (универсальная ) газовая
постоянная;
![]() – молярная масса водяного пара.
– молярная масса водяного пара.
Масса водяного пара, участвующего в процессе:
![]()
![]()
Калорические параметры ( )
1.2.1Случай
![]() (по
молекулярно-кинетической теории)
(по
молекулярно-кинетической теории)
Из таблиц молярных теплоёмкостей, полученных на основе молекулярно-кинетической теории, для водяного пара ( ), как трёхатомного идеального газа, находим:
молярная изобарная теплоёмкость

молярная изохорная теплоёмкость
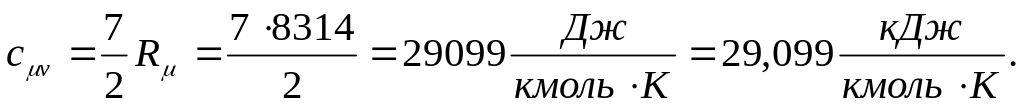
Удельные (массовые) теплоёмкости вычисляем по формулам пересчёта:
удельная изобарная теплоёмкость

удельная изохорная теплоёмкость

У
 дельная
энтальпия
дельная
энтальпия начало отсчёта
начало отсчёта
 ;
; начало отсчёта
начало отсчёта
 .
.
 Удельная
внутренняя энергия
Удельная
внутренняя энергия начало отсчёта
;
начало отсчёта
;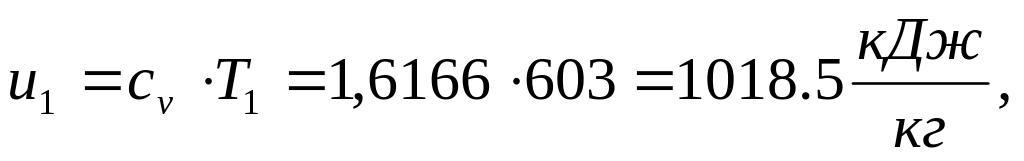 начало отсчёта
.
начало отсчёта
.
Удельная энтропия
 начало
отсчёта
начало
отсчёта
 ,
,
 .
.
1.2.2. Случай
![]() (по квантово-статистической теории).
(по квантово-статистической теории).
С помощью таблиц «Термодинамические свойства газов» (Ривкин С.Л.) для водяного пара ( ) как идеального газа при
 ,
находим:
,
находим:Удельная энтальпия
 ,
начало отсчёта
;
,
начало отсчёта
;Удельная внутренняя энергия
 ,
начало отсчёта
;
,
начало отсчёта
;Удельная энтропия рассчитывается по формуле
 , где
, где
 ,
начало отсчёта
,
.
,
начало отсчёта
,
.
С помощью таблиц средних теплоёмкостей для водяного пара ( ) как идеального газа при
 ,
находим:
,
находим:Средняя удельная изобарная теплоёмкость

Средняя удельная изохорная теплоёмкость
 ;
;Удельная энтальпия
 начало отсчёта
;
начало отсчёта
;Удельная внутренняя энергия
 начало отсчёта
;
начало отсчёта
;Удельная энтропия с помощью средних теплоёмкостей точно не вычисляется.

