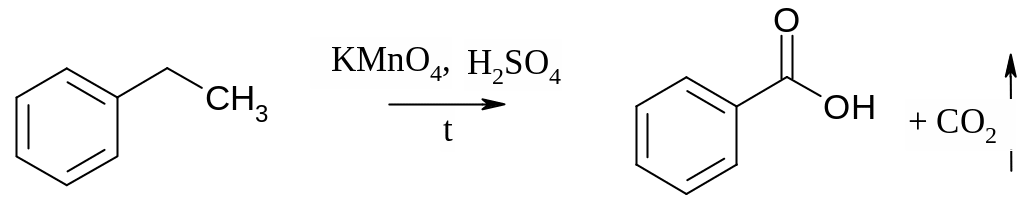- •Глава 2 свойства органических соединений качественные реакции
- •4.2.1. Лабораторные способы получения метана, этилена, ацетилена
- •4.2.2. Физические свойства углеводородов
- •4.2.3. Химические свойства углеводородов
- •4.3. Приборы и реактивы
- •4.4. Порядок проведения работы
- •5. Обработка результатов эксперимента
- •6. Контрольные вопросы
- •Лабораторная работа 5 спирты и фенолы
- •5.1. Цель работы
- •5.2. Теоретическое введение
- •5.2.1. Спирты
- •5.2.2. Фенолы
- •5.3. Приборы и реактивы
- •5.4. Порядок проведения работы
- •5.5. Обработка результатов эксперимента
- •5.6. Контрольные вопросы
- •Лабораторная работа 6 карбонильные соединения
- •6.1. Цель работы
- •6.2. Теоретическое введение
- •6.2.2. Карбонильные соединения
- •6.3. Приборы и реактивы
- •6.4. Порядок проведения работы
- •6.5. Обработка результатов эксперимента
- •6.6. Контрольные вопросы
- •Лабораторная работа 7 карбоновые кислоты и их производные
- •7.1. Цель работы
- •7.2. Теоретическое введение
- •7.2.1. Карбоновые кислоты
- •7.2.2. Сложные эфиры
- •7.2.3. Жиры
- •7.3. Приборы и реактивы
- •7.4. Порядок проведения работы
- •7.5. Обработка результатов эксперимента
- •7.6. Контрольные вопросы
- •Лабораторная работа 8 азотсодержащие органические соединения
- •8.1. Цель работы
- •8.2. Теоретическое введение
- •8.2.1 Основные свойства алифатических и ароматических аминов
- •8.2.2. Реакции азосочетания. Получение красителей
- •8.3. Приборы и реактивы
- •8.4. Порядок проведения работы Опыт 1. Получение и свойства метиламина.
- •8.5. Обработка результатов эксперимента
- •8.6. Контрольные вопросы
- •Лабораторная работа 9 высокомолекулярные соединения. Получение полимеров
- •9.1. Цель работы
- •9.2. Теоретическое введение
- •9.3. Приборы и реактивы
- •9.4. Порядок проведения работы
- •9.5. Обработка результатов эксперимента
- •9.6. Контрольные вопросы
Глава 2 свойства органических соединений качественные реакции
Каждый класс органических соединений характеризуется наиболее типичными химическими реакциями, которые используются в органическом синтезе и анализе, применяются для обнаружения функциональных групп и определенных структурных фрагментов молекулы. В настоящей главе приводятся лабораторные опыты, основанные на использовании подобных химических реакций. Для более тесной связи экспериментальных работ с общетеоретическим материалом произведено разделение опытов по классам и группам органических соединений. Опыты описываются только с точки зрения их выполнения, перед началом каждого раздела приведено краткое теоретическое введение. Для полного представления о химической сущности эксперимента необходимо обращаться к соответствующим разделам учебника и конспекта лекций, где можно будет почерпнуть материал для ответов на поставленные к каждому опыту вопросы.
Лабораторная работа 4
АЛИФАТИЧЕСКИЕ И АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
4.1. ЦЕЛЬ РАБОТЫ
Цель работы – ознакомление с особенностями физических и химических свойств алифатических и ароматических углеводородов, а также их качественными реакциями.
4.2. ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
4.2.1. Лабораторные способы получения метана, этилена, ацетилена
Метан можно синтезировать в лабораторных условиях сплавлением кристаллических ацетата натрия и едкой щелочи по реакции:
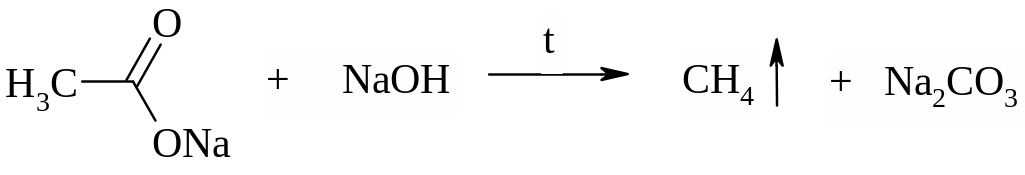
Этилен получают путем дегидратации этилового спирта под действием концентрированной серной кислоты. Реакция требует нагревания до 180 °С, при этой температуре начинает выделяться этилен, при более низкой температуре образуется диэтиловый эфир:
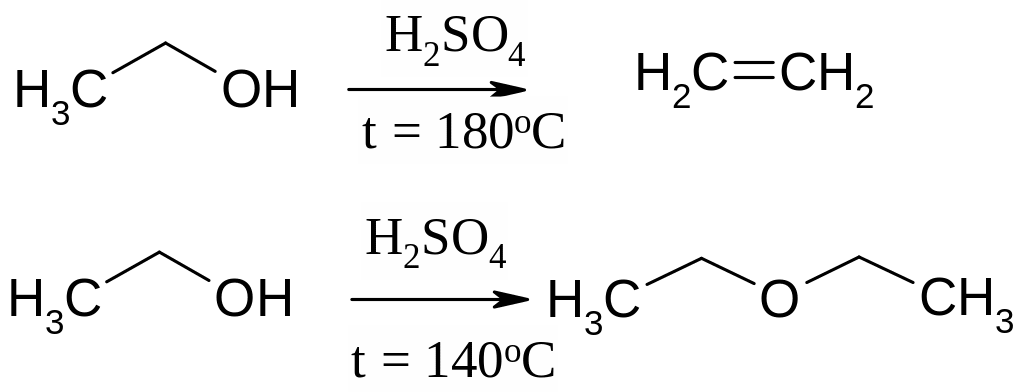
Ацетилен легко получить при действии воды на карбид кальция:
![]()
4.2.2. Физические свойства углеводородов
В ряду углеводородов с увеличением молекулярной массы повышаются температуры кипения и плавления. Так первые четыре члена гомологических рядов алифатических углеводородов при обычных условиях – газы, С5-С15 – жидкости, а начиная с С16 – твердые вещества. Как правило, углеводороды с разветвленной цепью кипят при более низких температурах, чем изомерные нормальные углеводороды. Наоборот, температура плавления тем выше, чем более разветвлена цепь.
Все углеводороды практически нерастворимы в воде, но хорошо растворяются в малополярных растворителях (бензоле, хлороформе и т.д.)
4.2.3. Химические свойства углеводородов
Химические свойства алканов определяются их строением. Атомы в молекулах алканов связаны малополярными ковалентными связями, поэтому алканы мало реакционноспособны. Имея насыщенный характер, алканы не вступают в реакции присоединения. В жестких условиях (нагревание до высоких температур, облучение ультрафиолетовым светом), когда становится возможным разрушение С-Н связей, алканы вступают в реакции замещения:

Алканы не проявляют ни кислотных, ни основных свойств, устойчивы к действию водных растворов кислот и щелочей. Алканы не реагируют с водными растворами окислителей (HNO3, H2SO4, KMnO4, K2Cr2O7, H2O2 и др.) даже при кипячении, но при поджигании на воздухе воспламеняются и горят:
![]()
Химические свойства алкенов определяются наличием в молекуле двойной углерод – углеродной связи. Наличие непрочной π-связи обуславливает реакции присоединения, протекающие с разрывом этой связи:

Благодаря наличию π-связи окисление алкенов перманганатом калия протекает даже в мягких условиях – 1-3 %-ный раствор перманганата калия в воде при температуре от 0 до 25оС:

Для алкинов также характерны реакции присоединения. Однако в целом алкины несколько менее активны, чем алкены:
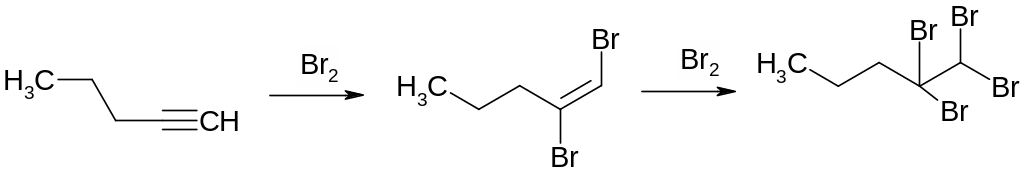
Алкины, имеющие атомы водорода, связанные с углеродом, находящимся в sp-гибридном состоянии, обладают кислотными свойствами, поэтому алкины реагируют со щелочными металлами и образуют нерастворимые моно- или диацетилениды при взаимодействии с комплексными соединениями серебра (I) и меди (I):
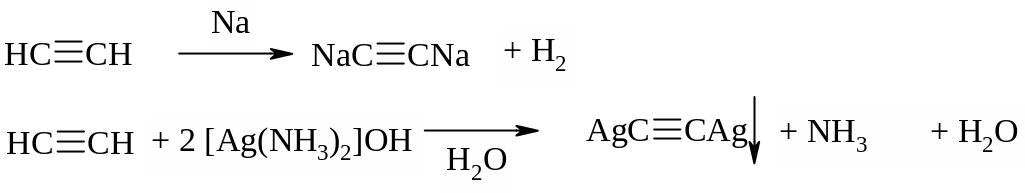
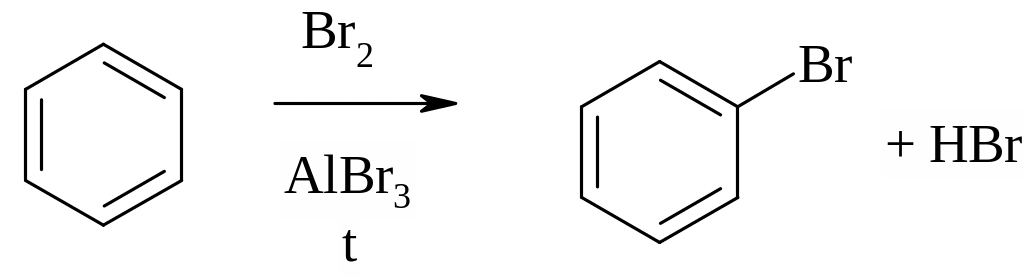
Для ароматических углеводородов, несмотря на их ненасыщенный характер, не свойственны реакции присоединения. В реакциях с бромом образуется продукт замещения, а сама реакция протекает при нагревании и только в присутствии катализатора (хлоридов или бромидов алюминия и железа (III)):
Бензол не взаимодействует с перманганатом калия даже при нагревании, гомологи бензола в тех же условиях окисляются до карбоновых кислот: