- •А. Газовые и газоконденсатные залежи (месторождения)
- •1. Физико-химические свойства природных газов и конденсата
- •Продолжение. Рисунок 5. Константы равновесия газ-гидрата компонентов природного газа при положительных температурах
- •Продолжение. Рисунок 5. Константы равновесия газ-гидрата компонентов природного газа при положительных температурах
- •Продолжение. Рисунок 6. Константы равновесия газ-гидрат компонентов природного газа при отрицательных температурах
- •2. Газовые и газоконденсатные залежи (месторождения).
- •Распределение температуры по стволу скважин
- •2.12. Режим газовых и газоконденсатных залежей
- •3. Методы подсчета запасов углеводородов
- •3.1. Объемный метод
- •3.2. Иногда пользуются методом по падению давления
- •3.4. Категории запасов углеводородов
- •4. Газо-гидродинамические методы (гдм) исследования газовых и газоконденсатных скважин и пластов
- •4.1. Подготовка скважин к гди
- •4.3. Методы исследования скважин и пластов
- •4.3.2. Газогидродинамические методы исследования скважин при нестационарных режимах фильтрации
- •4.3.3. Влияние различных факторов на форму квд
- •4.3.4. Обработка кривых стабилизации забойного давления
- •5. Системы добычи газа и газоконденсата
- •5.1. Виды промышленной эксплуатации залежей (месторождений)
- •5.1.3. Промышленная разработка и эксплуатация месторождений
- •5.1.4.2. Разработка газовой залежи при водонапорном режиме
- •5.1.5. Разработка газоконденсатных месторождений (залежей)
- •5.1.6. Разработка газоконденсатного месторождения без поддержания давления
- •6. Интенсификация добычи газа и нефти
- •6.1. Кислотная обработка забоев и прискважной зоны пласта
- •7. Сбор и подготовка газа к транспортировке
- •7.5. Осушка газа
- •Б. Нефтяные залежи (месторождения)
- •8.Физико-химические свойства нефти в пластовых и нормальных (атмосферных) условиях
- •9. Модели пласта и процессов вытеснения нефти
- •9.1. Поршневое вытеснение нефти
- •9.2. Непоршневое вытеснение нефти
- •9.3. Бесконечный пласт однородного строения
- •10. Освоение скважин
- •10.1. Вызов притока флюида из скважины
- •10.2. Определение коэффициента конденсатоотдачи пласта. Исследование на укг-3
- •11. Методы повышения извлекаемых запасов нефти и условия их применения
- •11.2. Вытеснение нефти растворителями и газом высокого давления
- •11.4. Силы, удерживающие нефть и газ в пласте
- •11.5. Коэффициент конденсатоотдачи. Исследование на укг-3
- •1, 2, 3, 4 Соответственно при температуре 1 ступени сепарации 30; 40; 50; 60 °с
- •12. Установление технологического режима работы скважины
- •12.2. Технологический режим работы скважин при наличии песчаной пробки или столба жидкости на забое
- •12.2.1. Определение дебита скважины при полном и частичном перекрытии пласта песчаной пробкой и столбом жидкости
- •12.2.2. Влияние депрессии на степень загрязнения забоя скважин и условия образования или разрушения пробки
- •12.3. Технологический режим работы скважин при наличии подошвенной воды
- •12.3.1. Определение предельного безводного дебита газовых скважин без учета подъема контакта газ-вода
- •12.3.2. Определение предельного безводного дебита с учетом подъема контакта газ-вода
- •12.3.3. Определение оптимального вскрытия газоносного пласта с подошвенной водой
- •12.4. Технологический режим работы скважины при одновременном притоке газа и подошвенной воды
- •12.5. Температурный технологический режим работы скважин
- •12.5.1. Безгидратный режим работы призабойной зоны и ствола скважины
- •12.6. Технологический режим работы скважин при наличии агрессивных компонентов в их продукции
- •12.7. Технологический режим работы скважин, вскрывших многопластовые залежи
- •13. Приборы и аппаратура для исследования скважин
- •13.1. Приборы и аппаратура для измерения давления
- •13.1.1. Пружинные манометры
- •13.1.2. Дифференциальные манометры
- •13.1.3. Глубинные манометры с местной регистрацией давления
- •13.2. Приборы и аппаратура для измерения температуры
- •13.3. Приборы и аппаратура для измерения дебита
- •13.3.1. Измерители расхода при докритическом течении газа
- •13.3.2. Измерители расхода при критическом течении газа
- •Коэффициента ∆ от рпр и Тпр
- •13.4. Дистанционные глубинные приборы и комплексы
- •13.6. Оборудование для спуска глубинных приборов
- •14. Промысловый сбор и подготовка нефти и газа
- •14.1. Системы сбора нефти и газа
- •14.2. Установки и сооружения систем сбора и транспорта нефти и газа
- •14.2.1. Замерные установки
- •14.2.2. Сепарационные установки
- •14.2.3. Промысловые трубопроводы и трубопроводная арматура
- •Расчет промысловых газопроводов
- •14.2.4. Нефтяные резервуары
- •14.2.5. Насосы для перекачки нефти
- •14.3. Образование нефтяных эмульсий и методы их разрушения
- •14.3.1. Разрушение нефтяных эмульсий (обезвоживание и обессоливание нефти)
- •14.3.2. Деэмульгаторы (пав) и требования, предъявляемые к ним
- •14.4. Измерение количества товарной нефти и определение ее качества
- •14.5. Хранение нефти в резервуарах
- •Определение давления насыщения нефти газом, объемного коэффициента, удельного веса и усадки нефти и воды в пластовых условиях Задача 1
- •Задача 2
- •Задача 3
- •Определение вязкости нефти и газа в пластовых условиях Задача 4
- •Задача 5
- •И температур от удельного веса газа
- •Определение коэффициента сжимаемости пластовой нефти и газа Задача 6
- •Задача 7
- •Определение скорости продвижения водонефтяного контакта Задача 8
- •Определение нефтеотдачи при водонапорном режиме Задача 9
- •Задача 10
- •Определение нефтеотдачи в зависимости от упругих свойств жидкости и породы Задача 11
- •Определение запасов нефти и оценка эффективности использования пластовой энергии Задача 12
- •Задача 13
- •Определение давления нагнетания, количества нагнетаемой жидкости и числа нагнетательных скважин Задача 14
- •Задача 15
- •Задача 16
- •Определение коэффициента нефтеотдачи и продолжительности процесса при площадном заводнении Задача 17
- •Определение количества газа, нагнетаемого в пласт для поддержания пластового давления Задача 18
- •Задача 19
- •Исследование фонтанных скважин методом установившихся отборов Задача 20
- •Задача 21
- •Задача 22
- •Задача 23
- •Задача 24
- •Исследование фонтанных скважин методом восстановления забойного давления Задача 25
- •Исследование газовых скважин методом установившихся отборов Задача26
- •Задача 27
- •Задача 28
- •Исследование газовых скважин методом восстановления забойного давления Задача 29
- •Исследование пластов
- •Задача 30
- •Задача 31
- •Задача 32
- •Оглавление
- •Список рисунков
- •Список таблиц
- •Список литературы
Министерство образования и науки Российской Федерации
Иркутский Государственный Технический Университет
Кафедра нефтегазового дела
Разработка и эксплуатация нефтяных и газовых месторождений
Учебное пособие
Составители:
Буглов Н. А.
Карпиков А. В.
Качин В. А.
Иркутск, 2010
А. Газовые и газоконденсатные залежи (месторождения)
1. Физико-химические свойства природных газов и конденсата
Добываемые на газовых, газоконденсатных, газонефтяных месторождениях природные газы представляют собой многокомпонентные системы, состоящие из предельных углеводородов и некоторых неуглеводородных соединений. Предельные углеводороды имеют формулу СnН2n+2 и в нормальных условиях представляют собою газы (в молекуле до 4 атомов углерода - от СН4 до С4Н10), жидкости (в молекуле до 26 атомов углерода), твёрдые (в молекуле более 26 атомов углерода). Тяжёлые УВ в зависимости от температуры и давления могут быть растворены в более лёгких. Из неуглеводородных соединений природные газы содержат N2, C02, H2S и др., а также инертные: Не, Ar, Cr, Xe, Ne. Как правило, природные газы насыщены парами воды, количество которых зависит от Т°, P и состава газа и самой воды.
Углеводороды, входящие в состав природных газов, имеют различные физические свойства (таблица 1).
Таблица 1 Основные параметры компонентов природного газа.
Показатели |
Компоненты |
||||||
СН4 |
С2Н6 |
С3Н8 |
n-C4H10 |
i-C4H10 |
n-C5H12 |
i-C5H12 |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
Молекулярная масса |
16,042 |
30,068 |
44,094 |
58,120 |
58,120 |
72,151 |
72,151 |
Молекулярный объем при 0 °С и 760мм рт. ст. |
22,36 |
22,16 |
21,82 |
21,50 |
21,75 |
20,87 |
20,87 |
Плотность при 0 °С и 760 кПа, кг/м3 |
0,7168 |
1,356 |
2,010 |
2,703 |
2,668 |
3,457 |
3,457 |
Плотность при 20 °С и 760 кПа, кг/м3 |
0,6679 |
1,263 |
1,872 |
2,5185 |
2,4859 |
3,221 |
3,221 |
Относительная плотность (по воздуху) |
0,555 |
1,049 |
1,562 |
2,091 |
2,067 |
2,674 |
2,490 |
Газовая постоянная, м/°С |
52,95 |
28,19 |
19,23 |
14,95 |
14,95 |
11,75 |
11,75 |
Теплоемкость при 0 °С и 760мм рт. ст., Cp/Cv, 4,1868·103 Дж/кг·град. |
0,5172 0,3936 |
0,3934 0,3273 |
0,3701 0,3252 |
0,3802 0,3466 |
0,3802 0,3465 |
0,3805 0,3533 |
0,3805 0,3533 |
Коэффициент динамической вязкости при 20 °С и 760мм рт. ст, 10-6 кг·с/м2 |
1,0484 |
0,8720 |
0,7649 |
0,6956 |
0,7027 |
0,6354 |
0,6507 |
Фактор ацентричности молекул, ω |
0,0104 |
0,0986 |
0,1524 |
0,0201 |
0,1849 |
0,2539 |
0,2223 |
Параметры потенциалов: |
|||||||
ε/k, К |
140,0 |
236,0 |
206,0 |
208,0 |
217,0 |
269,0 |
269,0 |
Продолжение таблицы 1
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
δ, А° |
3,808 |
4,384 |
5,420 |
5,869 |
5,819 |
0,099 |
6,057 |
δ безр. |
- |
- |
- |
- |
- |
- |
- |
Критическая температура Ткр, К° |
190,55 |
305,43 |
369,82 |
425,16 |
408,13 |
469,65 |
460,39 |
Критическое давление Ркр, кПа·100 |
46,95 |
49,76 |
43,33 |
38,71 |
37,19 |
34,35 |
34,48 |
Температура кипения Ткип , К° |
111,7 |
184,6 |
231,1 |
272,7 |
261,5 |
309,3 |
301,0 |
Теплопроводность при 0 °С и 760мм рт. ст., 1,163 вт/м2·град. |
0,026 |
0,016 |
0,013 |
0,011 |
0,010 |
0,0106 |
0,0106 |
|
С6Н14 |
С7Н16 |
С8Н18 |
N2 |
H12 |
Воздух |
|
Молекулярная масса |
86,178 |
100,198 |
114,22 |
28,016 |
2,016 |
28,96 |
|
Молекулярный объем при 0 °С и 760мм рт. ст. |
22,42 |
22,47 |
22,71 |
22,404 |
22,43 |
22,4 |
|
Плотность при 0 °С и 760 кПа, кг/м3 |
3,845 |
4,459 |
5,030 |
1,2503 |
0,0899 |
1,2928 |
|
Плотность при 20 °С и 760 кПа, кг/м3 |
3,583 |
4,155 |
4,687 |
1,1651 |
0,0837 |
1,2046 |
|
Относительная плотность (по воздуху) |
2,974 |
3,450 |
3,820 |
0,967 |
0,069 |
1,000 |
|
Газовая постоянная, м/°С |
9,84 |
8,46 |
7,42 |
30,26 |
420,63 |
29,27 |
|
Теплоемкость при 0 °С и 760мм рт. ст., Cp/Cv, 4,1868·103 Дж/кг·град. |
0,3827 0,3600 |
0,3846 0,3652 |
0,3856 0,3686 |
0,2482 0,1770 |
3,3904 2,4045 |
0,2397 0,1712 |
|
Коэффициент динамической вязкости при 20 °С и 760мм рт. ст, 10-6 кг·с/м2 |
0,6169 |
0,5500 |
0,5030 |
1,6981 |
0,8984 |
1,7419 |
|
Фактор ацентричности молекул, ω |
0,3007 |
0,3498 |
0,4018 |
0,040 |
0 |
- |
|
Параметры потенциалов: |
|||||||
ε/k, К |
423,0 |
288,0 |
333,0 |
91,5 |
33,3 |
78,6 |
|
δ, А° |
5,916 |
7,000 |
7,407 |
3,681 |
2,968 |
3,711 |
|
δ безр. |
- |
- |
- |
0 |
0 |
- |
|
Критическая температура Ткр, К° |
507,35 |
540,15 |
568,76 |
126,26 |
33,25 |
37,2 |
|
Критическое давление Ркр, кПа·100 |
30,72 |
27,90 |
25,35 |
34,65 |
13,25 |
132,4 |
|
Температура кипения Ткип К° |
341,9 |
371,6 |
398,9 |
77,3 |
20,4 |
78,8 |
|
Теплопроводность при 0 °С и 760мм рт. ст., 1,163 вт/м2·град. |
0,00966 |
0,0092 |
0,0084 |
0,020 |
0,148 |
0,021 |
|
Продолжение таблицы 1
|
Водяной пар |
О2 |
H2S |
SO2 |
CO2 |
CO |
NO2 |
NO |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
Молекулярная масса |
18,016 |
32,0 |
34,082 |
64,06 |
44,011 |
28,011 |
46,006 |
30,01 |
|
Молекулярный объем при 0 °С и 760мм рт. ст. |
23,45 |
- |
22,14 |
- |
22,26 |
22,41 |
- |
- |
|
Плотность при 0 °С и 760 кПа, кг/м3 |
1,8041 |
1,429 |
1,539 |
2,927 |
1,977 |
1,250 |
2,055 |
1,340 |
|
Плотность при 20 °С и 760 кПа, кг/м3 |
0,7496 |
1,3315 |
1,434 |
2,727 |
1,842 |
1,165 |
1,915 |
1,249 |
|
Относительная плотность (по воздуху) |
0,624 |
1,105 |
1,190 |
2,264 |
1,529 |
0,967 |
1,593 |
1,037 |
|
Газовая постоянная, м/°С |
47,06 |
26,47 |
24,89 |
- |
19,27 |
30,26 |
- |
- |
|
Теплоемкость при 0 °С и 760мм рт. ст., Cp/Cv, 4,1868·103 Дж/кг·град. |
0,4441 0,3469 |
0,2185 0,156 |
0,253 0,192 |
- |
0,1946 0,1496 |
0,2483 0,1774 |
- |
- |
|
Коэффициент динамической вязкости при 20 °С и 760мм рт. ст, 10-6 кг·с/м2 |
0,9006 |
1,948 |
1,2025 |
1,1804 |
1,3942 |
1,6951 |
- |
1,8358 |
|
Фактор ацентричности молекул, ω |
- |
0,019 |
0,100 |
0,598 |
0,231 |
- |
0,093 |
- |
|
Параметры потенциалов: |
|||||||||
ε/k, К |
- |
88 |
343 |
347 |
190 |
110 |
220 |
119 |
|
δ, А° |
- |
3,541 |
3,49 |
4,04 |
3,996 |
3,590 |
3,879 |
3,470 |
|
δ безр. |
- |
0 |
0,21 |
0,42 |
- |
- |
- |
0 |
|
Критическая температура Ткр, К° |
- |
154,78 |
373,6 |
430,65 |
304,2 |
132,93 |
100 |
180,3 |
|
Критическое давление Ркр, кПа·100 |
- |
51,8 |
91,85 |
80,49 |
75,27 |
35,27 |
431,0 |
66,64 |
|
Температура кипения Ткип , К |
- |
90 |
211,4 |
263,2 |
194,7 |
81,7 |
294,5 |
121,4 |
|
Теплопроводность при 0 °С и 760мм рт. ст., 1,163 вт/м2·град. |
0,015 |
- |
0,011 |
- |
0,012 |
- |
- |
- |
|
|
He |
Ar |
Kr |
Fr |
Cl2 |
Этил-меркаптан C2H5SH |
H2O |
Hg |
|
Молекулярная масса |
4,00 |
39,95 |
83,80 |
38,00 |
70,91 |
62,13 |
18,02 |
200,59 |
|
Молекулярный объем при 0 °С и 760мм рт. ст. |
- |
- |
- |
- |
- |
- |
- |
18,019 |
|
Продолжение таблицы 1
|
He |
Ar |
Kr |
Fr |
Cl2 |
Этил-меркаптан C2H5SH |
H2O |
Hg |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
Плотность при 0 °С и 760 кПа, кг/м3 |
0,178 |
1,784 |
- |
- |
3,233 |
0,84 |
- |
13 595 |
|
Плотность при 20 °С и 760 кПа, кг/м3 |
0,166 |
1,1662 |
- |
- |
3,012 |
- |
998,2 |
13 546 |
|
Относительная плотность (по воздуху) |
1,138 |
1,380 |
- |
|
2,501 |
|
|
|
|
Газовая постоянная, м/°С |
211,84 |
- |
- |
|
- |
|
|
|
|
Теплоемкость при 0 °С и 760мм рт. ст., Cp/Cv, 4,1868·103 Дж/кг·град. |
1,260 0,760 |
1,2430 - |
- |
- |
- |
- |
1,0074 - |
0,0335 - |
|
Коэффициент динамической вязкости при 20 °С и 760мм рт. ст, 10-6 кг·с/м2 |
1,8970 |
2,1265 |
2,3764 |
- |
1,2698 |
- |
1,004 |
- |
|
Фактор ацентричности молекул, ω |
0,246 |
- |
0,002 |
0,071 |
0,082 |
- |
0,348 |
- |
|
Параметры потенциалов: |
|||||||||
ε/k, К |
10,8 |
124,9 |
166,7 |
112,0 |
357,0 |
447,6 |
775,0 |
- |
|
δ, А° |
2,57 |
3,423 |
3,679 |
3,653 |
4,117 |
4,644 |
2,52 |
- |
|
δ безр. |
0 |
0 |
0 |
- |
- |
0,156 |
1,0 |
- |
|
Критическая температура Ткр, К° |
5,2 |
150,72 |
309,41 |
144,2 |
417,2 |
499 |
647,4 |
- |
|
Критическое давление Ркр, кПа·100 |
2,34 |
49,59 |
56,0 |
56,83 |
78,63 |
56,0 |
225,55 |
- |
|
Температура кипения Ткип К |
4,3 |
87,5 |
121,4 |
86,2 |
238,6 |
- |
373,2 |
- |
|
Теплопроводность при 0 °С и 760мм рт. ст., 1,163 вт/м2·град. |
0,123 |
- |
- |
- |
- |
- |
- |
- |
|
В зависимости от количества лёгких или тяжёлых (С3Н8 + С4Н10) газ делится на сухой и жирный. Сухой газ без тяжелых УВ или содержит его очень мало. Жирный газ содержит тяжелые УВ или газовый бензин (конденсат).
При разработке УВ залежей (месторождений) всегда сталкиваемся с законами изменения состояния газов как многокомпонентных систем. Основные законы: 1) Бойля-Мариота; 2) Гей-Люссака; 3) Авогадро; 4) Клапейрона - Менделеева.
1) Закон
Бойля-Мариота - при изотермическом
сжатии удельный объем идеального газа
изменяется обратно пропорционально
давлению
![]() и P1V1=
P2V2.
и P1V1=
P2V2.
2) Закон
Гей-Люссака - удельный объем идеального
газа при постоянном давлении увеличивается
при повышении температуры VT
= V0(1
+ aVt).
Vo
-
начальный
объем газа при Т=0 С0
, VT
-
объем
газа при температуре t
С0,
aV
-
температурный
коэффициент объемного расширения =
0,0036604. При V=const
с ростом Т° повышается давление газа
PT
= P0(1
+ aТТ).
Для идеального газа aV
=
аТ.
При
Р=const
можно написать
![]() и при V=const
и при V=const
![]() , где Т- термодинамическая температура
T=273,16+t
С°.
, где Т- термодинамическая температура
T=273,16+t
С°.
3) Закон
Авогадро - равные объемы идеальных газов
при одинаковых Р и Т содержат одинаковое
число молекул (N=6,02·1026K·
моль-1),
т.е.
![]() ,
т.е плотности газов ρ1
и
ρ2
пропорциональны их молекулярным массам
М1
и М2.
Или
,
т.е плотности газов ρ1
и
ρ2
пропорциональны их молекулярным массам
М1
и М2.
Или
![]()
![]() при
0 С° и 101,325 кПа (1 атм.=760мм, рт. ст.) молярный
объем газа = 22,4136 м³/К·моль. Тогда
при
0 С° и 101,325 кПа (1 атм.=760мм, рт. ст.) молярный
объем газа = 22,4136 м³/К·моль. Тогда
![]() кг/
м³.
кг/
м³.
4) Закон Менделеева-Клапейрона для идеальных газов PV=vRT, где Р - давление в Па, V - объем газа в м³, v-количество газа в К·моль, R - универсальная газовая постоянная (R=8,31434·103 Дж/к·моль0·К). Этот закон для низких давлений. Для реальных газов используют уравнение Ван-дер-Ваальса, Битти-Бриджмена и др.
Основные физические свойства газа и конденсата: плотность кг/м³ или г/см³; давление в атмосферах, мПа, Па; температура в С0 и К0; вязкость пуаз, спуаз, кг·с/см²; коэффициент сверхсжимаемости газа; влагосодержание газа г/м³; теплоемкость Дж/кг·С°, ккал/кг·С°.
1.1.
Плотность газа
- масса
единицы объема газа. Плотность газа
известного состава определяется как
сумма произведений плотности отдельных
компонентов на их объемное (молярное
содержание),
![]() или
по известным молекулярным массам
или
по известным молекулярным массам
![]()
Плотность
сухого газа при Т0
и Р определяется
![]() где ρн
–
плотность при 20 Сº и 760мм рт. ст, кг/м³; z
-коэффициент сверхсжимаемости газа при
Р и Т0.
Если в газе пары воды, плотность его
равна
где ρн
–
плотность при 20 Сº и 760мм рт. ст, кг/м³; z
-коэффициент сверхсжимаемости газа при
Р и Т0.
Если в газе пары воды, плотность его
равна
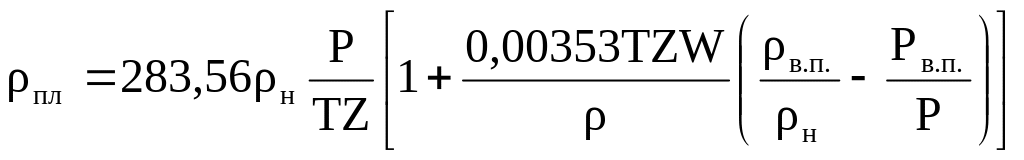 ,
где W
– влагосодержание; ρв.п
-
плотность насыщенного водяного пара,
кг/м³; Pв.п.
-
давление насыщенного водяного пара,
кг/см².
,
где W
– влагосодержание; ρв.п
-
плотность насыщенного водяного пара,
кг/м³; Pв.п.
-
давление насыщенного водяного пара,
кг/см².
В
газоконденсатных скважинах плотность
смеси определяется по формуле:
![]() где ρ и ρk
-
плотность газа и конденсата после
сепаратора при 20 С0
и 760мм. рт. ст. кг/м³ ; Qr,
Qk
- дебиты
газа
и конденсата при 20 С0
и 760мм. рт. ст., м³/сутки, При тех же условиях
где ρ и ρk
-
плотность газа и конденсата после
сепаратора при 20 С0
и 760мм. рт. ст. кг/м³ ; Qr,
Qk
- дебиты
газа
и конденсата при 20 С0
и 760мм. рт. ст., м³/сутки, При тех же условиях
![]() кажущийся объемный коэффициент
конденсата, Mk
-молярная
масса конденсата.
кажущийся объемный коэффициент
конденсата, Mk
-молярная
масса конденсата.
Пример. Рассчитать плотность газа при Р=15,0·мПа и T=30ºC.
Таблица 2 Расчет плотности газа
Состав газа |
%, Xi |
Pi |
PiXi |
ω |
Xiω1 |
СН4 |
74,1 |
0,6679 |
0,4949 |
0,0104 |
0,007710 |
С2Н6 |
7,48 |
1,2630
|
0,0964 |
0,0986 |
0,007375 |
С3Н8 |
3,37 |
1,872 |
0,0630 |
0,1524 |
0,005135 |
iС4Н10 |
0,76 |
2,4859 |
0,0188 |
0,1849 |
0,001405 |
С4Н10 |
1,68 |
2,5185 |
0,0423 |
0,1010 |
0,003376 |
iС5Н12 |
0,57 |
3,221 |
0,0183 |
0,2223 |
0,001267 |
С5Н12 |
0,32 |
3,221 |
0,0183 |
0,2539 |
0,000812 |
С6Н14 |
0,63 |
3,583 |
0,0225 |
0,3007 |
0,001894 |
N2 |
6,09 |
1,1651 |
0,0709 |
0,0400 |
0,002436 |
H2S |
2,0 |
1,434 |
0,0286 |
0,1200 |
0,002000 |
C02 |
3,0 |
1,542 |
0,0552 |
0,3310 |
0,006930 |
Сумма |
100=∑Xi |
|
0,9192=∑PiXi=ρн
|
|
∑=0,04034 |
∑PiXi=0,9192кг/м³
![]() - относительный удельный вес (по воздуху).
- относительный удельный вес (по воздуху).
По
формуле
![]()
![]() кг/м³,
приняли z=1.
кг/м³,
приняли z=1.
Пример.
Определить плотность ГКС (газоконденсатной
смеси) при рг=0,723
кг/м³; (![]() =0,6);
рк=740
кг/м³, содержащего конденсата в газе
300см³/м³. Qг=200тыс
м³/сутки. Молекулярная масса конденсата
М=149 кг/к.моль.
=0,6);
рк=740
кг/м³, содержащего конденсата в газе
300см³/м³. Qг=200тыс
м³/сутки. Молекулярная масса конденсата
М=149 кг/к.моль.
1) Суточный дебит конденсата Qк =0,3·10-3·200·103=60м³/сут.
2) По
формуле
![]()
3) По
формуле
![]() г/см³.
г/см³.
1.2. Давление - измеряемое в соответствующих условиях, мПа, Па, кг/см².
1.3. Температура - по Цельсию в С0 и термодинамическая - К = 273 + С0.
1.4. Вязкость - свойство сопротивляться перемещению одних частиц относительно других. Зависит от температуры и давления. Это сила сдвига на ед. площади, отсюда ее размерность - сила·время/длина². Или масса/длина·время. Более распространена пуаз и сантипуаз. Расчет ее проводят в 2 этапа - сначала при заданной Т° и Ратм; затем полученное значение пересчитывают на заданное давление. Графическим и аналитическим методом.
1.5.
Коэффициент сверхжимаемости газа
- функция давления, температуры и состава
газа. Его определяют, исходя из состава
газа. В инженерных расчетах чаще
пользуются обобщенным уравнением
Менделеева-Клапейрона, в которое вводится
коэффициент сверхсжимаемости, учитывающий
отклонение реальных газов от идеальных.
PV=zRT.
Заменив уд. объем на плотность газа
получим P=pzRT.
z-коэффициент
сверхжимаемости газа; R
- газовая постоянная, м/ С0.
Критическое состояние вещества, при
котором плотность его и насыщенного
пара этого вещества равны друг другу.
Параметры, соответствующие этому
состоянию, называются критическими
параметрами. Для природного газа,
являющегося смесью УВ и неУВ компонентов,
критические параметры определяются
как псевдокритические по составу газа.
Когда в газе меньше 10% объема высококипящих
УВ и неУВ компонентов, псевдокритические
параметры определяются по формулам:
![]()
![]() ,
где pп.кр
– псевдокритическое давление газа,
кгс/см²; Tп.кр
– псевдокритическая, К; pкр,
Tкр
– критические давление, температура
i-го
компонента, определяемое по таблицам
(см. таблицу 1); x
i
– молярное (объемное) содержание i-го
компонента.
,
где pп.кр
– псевдокритическое давление газа,
кгс/см²; Tп.кр
– псевдокритическая, К; pкр,
Tкр
– критические давление, температура
i-го
компонента, определяемое по таблицам
(см. таблицу 1); x
i
– молярное (объемное) содержание i-го
компонента.
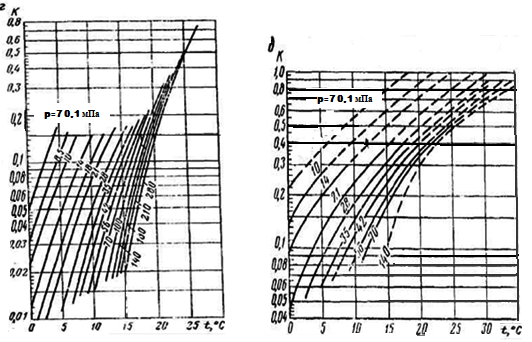
В том случае, когда компонентный состав газа неизвестен, псевдокритические параметры можно определить по относительной плотности газа (рис. 2а, 2б). При наличии в газе азота, сероводорода и углекислого газа в псевдокритические параметры вводятся поправки с соответствующим знаком.
Приведенными параметрами называются отношения соответствующих параметров к их критическим значениям pпр=p/pкр, Тпр=Т/Ткр.
Критические и приведенные параметры позволяют использовать принцип соответственных состояний для определения коэффициента сверхсжимаемости, вязкости и некоторых других характеристик газа.
Принцип соответственных состояний заключается в том, что если два или несколько веществ, удовлетворяющих одному и тому же приведенному уравнению состояния, имеют одинаковые два из трех приведенных параметров, то и третий приведенный параметр будет у них также одинаков. Так как в критической точке приведенные параметры одинаковы и равны единице, критические состояния всех веществ являются соответственными.
Пример.
Определить z
газа при Р=150 атм. и Т=303 К, состав которого
в таблице 2. Tкр=218,4,
Ркр=47,6.
Определяем
![]() ,
,
![]() По графику z=0,7.
Порядок определения z
(по двум параметрам):
По графику z=0,7.
Порядок определения z
(по двум параметрам):
Находят критические параметры Ркр и Ткр
Рассматривают приведенные параметры Рпр и Тпр
По графикам определяют для рассчитанных pпр и Тпр. коэффициент z.
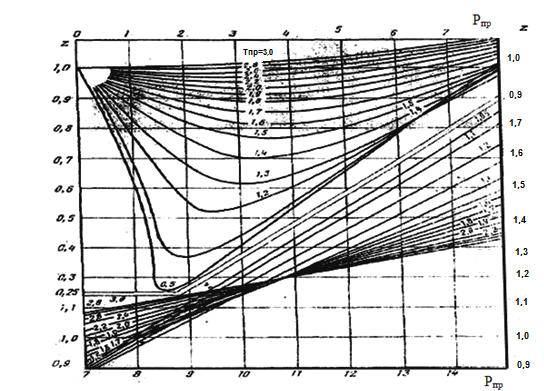
Рисунок 1. Зависимость коэффициента сверхсжимаемости для природного газа от приведенного давления и температуры
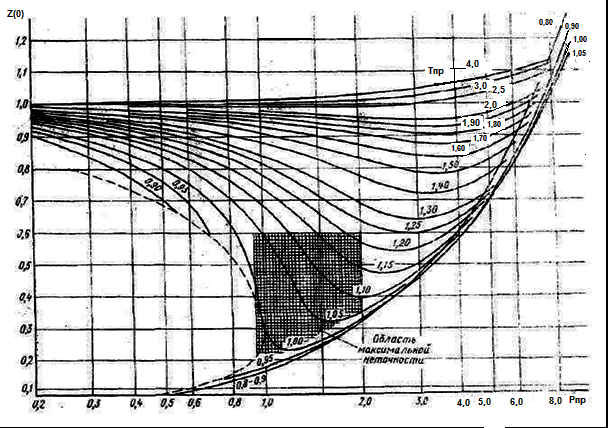
Рисунок 2. График для определения коэффициента сжимаемости z(0) простых веществ
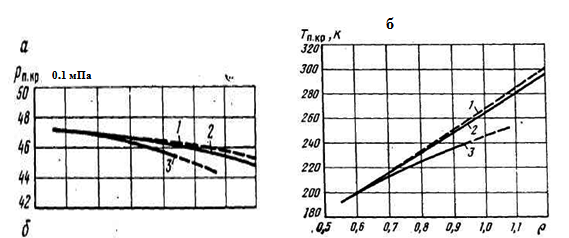
Рисунок 2а. Псевдокритические давления (а) и температуры (б) природных газов
1 – углеводородные газы; 2 – смесь газов; 3 – продукция газоконденсатных скважин.
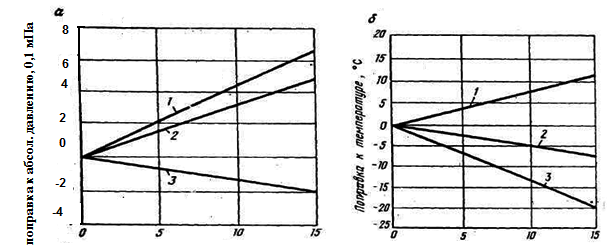
Содержание неуглеводородного компонента, об.%
Рисунок 2б. Поправки к псевдокритическим давлениям (а) и температурам (б), определяемым по рис. 2а для газов, содержащих примеси
Примесь: 1 – H2S; 2 - СO2; 3 - N2
Пример.
Предыдущий газ. Рассчитываем фактор
ацентричности по ω=0,04034 (табл. 2), по
формуле
![]() .
.
Порядок
определения z
по 3 параметрам, когда в
газе суммарная
молярная концентрация высококипящих
УВ и неУВ
компонентов
превышает 10%. 3-ий параметр и есть
фактор ацентричности
ω молекул, который для смеси определяется
по
формуле:
![]() (табл2.). Коэффициент z
по 3 параметрам, определяется по формуле
(табл2.). Коэффициент z
по 3 параметрам, определяется по формуле
![]() .
.
![]() и
и
![]() в зависимости от pпр
и Тпр.
находят
по графикам. Естъ
аналитические
методы определения коэффициента
сверхсжимаемости,
но это очень сложные расчеты
и без компьютера
не обойтись.
в зависимости от pпр
и Тпр.
находят
по графикам. Естъ
аналитические
методы определения коэффициента
сверхсжимаемости,
но это очень сложные расчеты
и без компьютера
не обойтись.
1.6. Влагосодержание газа W - абсолютная, в г/м³; и относительная, доли единицы. Относительная W - отношение фактического количества паров воды в единице объема при определенных Р и Т° к его влагоемкости, т.е. при полном насыщении при этих Р и Т°.
Для
расчета
![]() А - влагосодержание идеального
газа; β – коэффициент зависящий
от состава газа;
Р
- заданное
давление кг/см². А
и β в таблице 3.
А - влагосодержание идеального
газа; β – коэффициент зависящий
от состава газа;
Р
- заданное
давление кг/см². А
и β в таблице 3.
Таблица 3 Значение коэффициентов А и В в уравнении влагосодержания газа
t, ºС |
А |
В |
t, ºС |
А |
В |
t, ºС |
А |
В |
-40 -38 -36 -34 -32 -30 -28 -26 -24 -22 -20 -18 -16 -14 -12 -10 -8 -6 -4 -2 0 2 4 6
|
0,1451 0,1780 0,2189 0,2670 0,3235 0,3930 0,4715 0,5660 0,6775 0,8090 0,9600 1,1440 1,350 1,590 1,868 2,188 2,550 2,990 3,480 4,030 4,670 5,400 6,225 7,150
|
0,00347 0,00402 0,00465 0,00538 0,00623 0,00710 0,00806 0,00921 0,01043 0,01168 0,01340 0,01510 0,01705 0,01927 0,021155 0,02290 0,0271 0,03035 0,03380 0,0377 0,0418 0,0464 0,0515 0,0571
|
8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 54
|
8,200 9,390 10,72 12,39 13,94 15,75 17,87 20,15 22,80 25,50 28,70 32,30 36,10 40,50 45,20 50,80 56,25 62,70 69,25 76,70 85,29 94,99 103,00 114,00
|
0,0630 0,0696 0,0767 0,0855 0,0930 0,1020 0,1120 0,1227 0,1343 0,1453 0,1595 0,1740 0,1895 0,207 0,224 0,242 0,263 0,285 0,310 0,335 0,363 0,391 0,422 0,454
|
56 58 60 62 64 66 68 70 72 74 76 78 80 82 84 86 88 90 92 94 96 98 100 НО |
126,00 138,0 152,0 166,5 183,3 200,5 219,0 238,5 260,0 306,0 335,0 363,0 394,0 427,0 462,0 501,0 537,5 582,5 624,0 672,0 725,0 776,0 1093,0
|
0,487 0,521 0,562 0,599 0,645 0,691 0,741 0,793 0,841 0,902 0,965 1,023 1,083 1,148 1,205 1,250 1,290 1,327 1,327 1,405 1,445 1,487 1,530 2,620
|
Таблица 4 Упругость паров в зависимости от температуры
t, ºС |
pв.п, 0,1 мПа |
t, ºС |
pв.п, 0,1 мПа |
t, ºС |
pв.п, 0,1 мПа |
-40 -35 -30 -25 -20 -15 -10 -5 0 5 |
0,00013 0,60023 0,00038 0,00064 0,00105 0,00168 0,00265 0,00490 0,00620 0,00890 |
10 15 20 25 30 35 40 45 50 55 |
0,0125 0,0174 0,0238 0,0323 0,0435 0,0573 0,0752 0,0977 0,1258 0,1605 |
60 65 70 75 80 85 90 95 100 110 |
0,2031 0,2550 0,3178 0,3931 0,4829 0,5894 0,7149 0,8619 1,0332 1,4609 |
1.7. Теплоемкость газа - отношение теплоты, подведенной к нему, к соответствующему изменению температуры газа. Если к единице количества газа, то это удельная (массовая или молярная) теплоемкость - Дж/кг·С° или ккал/кг·С° ( кал./г·С°), 1кал./г·С°=4,1868 Дж/кг·С° или Дж/моль·С°, ккал/моль·С°. Изобарная теплоемкость (при P=const).
1.8. Гидратообразование - природный газ в соединении с водой при определенных условиях образует гидраты - твердые кристаллические вещества. Это не химические, а физические соединения, т.е. молекулы воды входят в межмолекулярное пространство газа. Гидраты очень осложняют процесс исследования и эксплуатации скважин, с ними приходится бороться. Несколько методов определения условий гидратообразований:
1) Экспериментальный - с помощью малогабаритного оборудования в лабораторных и промысловых условиях. Основной узел установки - камера высокого давления (до 25,0 мПа и Т=-30 +50 С°), объем ее 40- 80см³.
2)
В поисковом и разведочном процессе
приходится пользоваться приближенными
аналитическими зависимостями на основе
экспериментальных данных. Из них
следует:![]() ,
где
а
и
b
коэффициенты,
оцениваемые
экспериментально для каждого месторождения
(а =12,25-19,9; b=-3,3-(-28,5)).
Для Р больше 9,0 мПа, Т гидратообразования
приближенно можно оценить:
,
где
а
и
b
коэффициенты,
оцениваемые
экспериментально для каждого месторождения
(а =12,25-19,9; b=-3,3-(-28,5)).
Для Р больше 9,0 мПа, Т гидратообразования
приближенно можно оценить:
при
положительных температурах:
![]() ,
,
![]() ;
;
при
отрицательных температурах:
![]() ,
,
![]() ,
где β и β1,
в рис. 3 в зависимости от отношения суммы
парциальных плотностей изучаемого газа
,
где β и β1,
в рис. 3 в зависимости от отношения суммы
парциальных плотностей изучаемого газа
![]() к
сумме их объемных (в долях единиц)
концентраций в газе. Надо знать состав
газа (табл. 2).
к
сумме их объемных (в долях единиц)
концентраций в газе. Надо знать состав
газа (табл. 2).
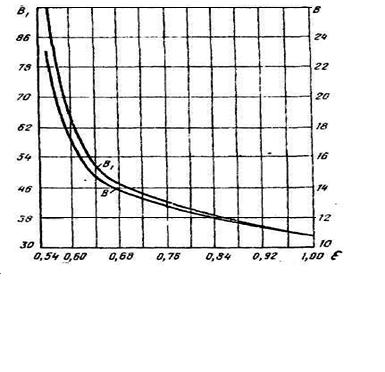
Рисунок 3. Значения коэффициентов В и В1
Пример. Определить Pгидр при Т=10ºС. Состав газа в таблице 5.
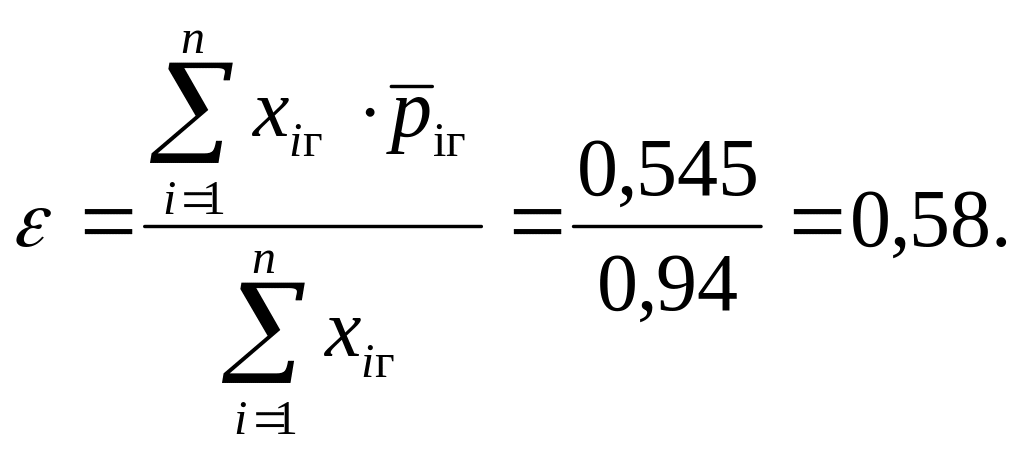
Из графика (рис. 3) находим β=19, тогда lgPp=0,054(10+19)=1,57, Pp=3,71 мПа.
Таблица 5 Результаты расчетов по определению давления гидратообразования
Компонент |
Молекулярная концентрация в газе, % |
xiг |
piг |
xiг· piг |
C1 |
90 |
0,900 |
0,554 |
0,499 |
C2 |
2 |
0,020 |
1,049 |
0,0621 |
C3 |
1 |
0,810 |
1,561 |
0,615 |
iC4 |
0,5 |
0,005 |
2,864 |
0,010 |
C4 |
0,5 |
0,005 |
- |
- |
iC5 |
0,5 |
- |
- |
- |
C5 |
0,5 |
- |
- |
- |
C6+В |
0,4 |
- |
- |
- |
N2 |
4,6 |
- |
- |
- |
Сумма: |
100 |
0,94 |
- |
0,545 |
Пример.
Pгд.=5,0
мПа. Состав газа в таблице 5. Какова
Тгидр.?
ε =0,58 β=19. Тогда
![]() Сº.
СО2
и H2S
ускоряют процесс гидрообразования.
Сº.
СО2
и H2S
ускоряют процесс гидрообразования.
3) Графический метод равновесной T и P по отдельным компонентам (рис. 4).

Рисунок 4. Зависимость равновесных параметров гидратообразования природных газов от их плотности
Условия
гидратообразования по константам
равновесия определяют, используя
константы фазового равновесия газ-гидрат,
выражаемые формулой
![]() ,
где yi
-
молярная доля i-ro
компонента природного газа в газовой
фазе; xi
- молярная доля i-ro
компонента газа в гидрате. При известных
для заданного условия значениях констант
фазового равновесия Ki
и составе газа, молярную долю компонентов
можно вычислять из выражения
,
где yi
-
молярная доля i-ro
компонента природного газа в газовой
фазе; xi
- молярная доля i-ro
компонента газа в гидрате. При известных
для заданного условия значениях констант
фазового равновесия Ki
и составе газа, молярную долю компонентов
можно вычислять из выражения
![]() .
.
Если
![]() ,
то при данных условиях гидраты не
образуются.
,
то при данных условиях гидраты не
образуются.
Равновесные условия образования гидратов выражаются равенством:
![]() .
.
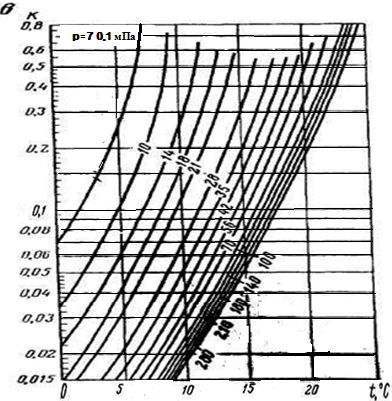
Константы фазового равновесия газ-гидрат зависят от давления, температуры и состава газа. Константы равновесия при положительных температурах определяются по графикам, приведенным на рис. 5 при отрицательных температурах — на рис. 6.
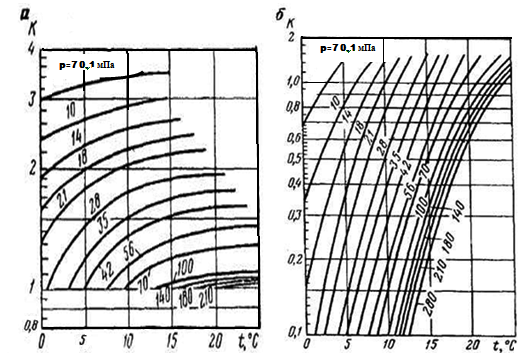
Рисунок 5. Константы равновесия газ-гидрата компонентов природного газа при положительных температурах