
- •Вариант №1
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №2
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №3
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант № 4
- •Определить концентрацию ионов водорода в растворе, рН которого равен 3,4?
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №5
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Вариант №6
- •Определить концентрацию ионов водорода в растворе, рН которого равен 12,8?
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №7
- •Определить концентрацию ионов водорода в растворе, рН которого равен 8,8?
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №8
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №9
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса
- •Вариант №10
- •В 500 мл воды при 18°с растворяется 0,0166 гAg2CrO4. Чему равно произведение растворимости этой соли?
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Вариант №11
- •Определить концентрацию ионов водорода в растворе, рН которого равен 13,5?
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Вариант №12
- •Определить концентрацию ионов водорода в растворе, рН которого равен 1,5?
- •Вариант №13
- •Определить концентрацию ионов водорода в растворе, рН которого равен 0,5?
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №14
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Вариант №15
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Вариант №16
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Определить концентрацию ионов водорода в растворе, рН которого равен 2,5?
- •Вариант №17
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Во сколько раз растворимость (в моль/л) Fe(oh)2в воде больше растворимости Fe(oh)3 при 25°с? и .
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №18
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Определить концентрацию ионов водорода в растворе, рН которого равен 1,2?
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №19
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Определить концентрацию ионов водорода в растворе, рН которого равен 5,8?
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №20
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
Сколько граммов растворенного вещества и сколько граммов воды содержится в 120 г 6%-ного раствора аммиака NH3?
Вычислите молярную концентрацию 27,1%-ного раствора хлорида аммония NH4Cl ( ).
Давление пара воды при 10°С составляет 1228 Па. В каком количестве воды следует растворить 23 г глицерина C3H8O3 для получения раствора, давление пара которого составляет 1200 Па при той же температуре?
Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
O2 + SnCl2 + HCl → H2SnCl6 + H2O + …
Fe + HNO3 → Fe(NO3)3 + NO2 + …
Zn + K2Cr2O7 + HCl → ZnCl2 + CrCl3 + …
FeCl2 + Cl2 → FeCl3
KClO3 → KClO4 + KCl
Написать ионное и молекулярное уравнения гидролиза (NH4)2СO3 и указать реакцию среды раствора. Найти степень гидролиза при концентрации соли = 0,5 моль/л
Образуется ли осадок сульфата серебра, если к 0,02 Мраствору AgNO3добавить равный объем 1 н. раствора H2SO4?
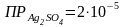 .
.
Определить концентрацию ионов водорода в растворе, рН которого равен 2,5?
Каково значение рН 0,8 М раствора гидроксида лития?
Определите рН раствора селеноводородной кислоты H2Se (считая ее диссоциацию только по 1 ступени) с концентрацией 0,06 моль/л. (K1=1,7 .10-4)
При электролизе в течение 30 минут раствора NaCl на аноде выделилось 2,8 л хлора, измеренных при 0°С и 101,3 кПа. Вычислите силу тока электролиза.
ИДЗ «Растворы. Окислительно-восстановительные реакции»
Вариант №17
Сколько граммов растворенного вещества содержит 1 л 0,3M. раствора H3PO4?
Вычислите моляльную концентрацию 12%-ного раствора гидроксида калия KOH ( ).
При какой температуре осмотическое давление, содержащего в 1 л45 г глюкозы C6H12O6, достигнет 607,8 кПа?
Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
O2 + Fe(OH)2 + H2O → Fe(OH)3 + …
Bi + HNO3 → Bi(NO3)3 + NO + …
KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + …
FeCl2 + Cl2 + NaOH → FeCl3 + NaCl + …
S + KOH → K2SO3 + K2S + …
Во сколько раз растворимость (в моль/л) Fe(oh)2в воде больше растворимости Fe(oh)3 при 25°с? и .
Написать ионное и молекулярное уравнения гидролиза NiCl2 и указать реакцию среды раствора. Определить рН раствора, если концентрация соли равна 0,007 М.
Каково значение рН 0,04 М раствора азотной кислоты?
Определить концентрацию гидроксид-ионов в растворе, рН которого = 12?
Определите рН раствора гироксида аммония с концентрацией 0,08 моль/л. (Кв=1,8 .10-5)
При электролизе раствора AgNO3 в течение 50 минут при силе тока в 3 А на катоде выделилось 9,6 г серебра. Определите выход серебра в процентах от теоретического.
Идз «Растворы. Окислительно-восстановительные реакции» Вариант №18
Сколько граммов вещества следует взять для приготовления 100 мл 0,4М раствора BaBr2?
Вычислите нормальную концентрацию 18%-ного раствора аммиака NH3 ( ).
Раствор, содержащий 5,4 г вещества-неэлектролита в 200 г воды, кипит при 100,078°С. Вычислите молекулярную массу растворенного вещества, если эбулиоскопическая константа воды равна 0,52°.
Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
Br2 + Fe(OH)2 + NaOH → Fe(OH)3 + NaBr + …
Bi + HNO3 → Bi(NO3)3 + NO2 + …
Na2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + …
KMnO4 + K2SO3 + KOH → K2MnO4 + K2SO4 + …
ClO2 + Ba(OH)2 → Ba(ClO2)2 + Ba(ClO3)2 + …
