
- •Вариант №1
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №2
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №3
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант № 4
- •Определить концентрацию ионов водорода в растворе, рН которого равен 3,4?
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №5
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Вариант №6
- •Определить концентрацию ионов водорода в растворе, рН которого равен 12,8?
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №7
- •Определить концентрацию ионов водорода в растворе, рН которого равен 8,8?
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №8
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №9
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса
- •Вариант №10
- •В 500 мл воды при 18°с растворяется 0,0166 гAg2CrO4. Чему равно произведение растворимости этой соли?
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Вариант №11
- •Определить концентрацию ионов водорода в растворе, рН которого равен 13,5?
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Вариант №12
- •Определить концентрацию ионов водорода в растворе, рН которого равен 1,5?
- •Вариант №13
- •Определить концентрацию ионов водорода в растворе, рН которого равен 0,5?
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №14
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Вариант №15
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Вариант №16
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Определить концентрацию ионов водорода в растворе, рН которого равен 2,5?
- •Вариант №17
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Во сколько раз растворимость (в моль/л) Fe(oh)2в воде больше растворимости Fe(oh)3 при 25°с? и .
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №18
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Определить концентрацию ионов водорода в растворе, рН которого равен 1,2?
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №19
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Определить концентрацию ионов водорода в растворе, рН которого равен 5,8?
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №20
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
Сколько граммов растворенного вещества содержит 1 л 0,3M. раствора AlCl3?
Вычислите молярную концентрацию 68,3%-ного раствора нитрата серебра AgNO3 (
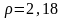 ).
).Вычислите осмотическое давление 1%-ного раствора сахара C12H22O11 при 30°С, принимая плотность раствора равной единице.
Написать ионное и молекулярное уравнения гидролиза (NH4)2СO3 и указать реакцию среды раствора. Найти степень гидролиза при концентрации соли = 0,35 моль/л
Вычислить произведение растворимости РbВr2 при 25 °С, если растворимость соли при этой температуре равна 1,32·10-2 моль/л.
Определить рН 0,09M. раствора соляной кислоты.
Определите рН раствора азотистой кислоты с концентрацией 0,008 моль/л. ( Ka=4,6 .10-4)
Определить концентрацию ионов водорода в растворе, рН которого равен 13,5?
Рассчитайте силу тока, при которой через электролизер с раствором, содержащим 784,4 г KOH, пропускали ток в течение двух суток, если после окончания процесса масса KOH в растворе составляет 848 г.
Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
Br2 + H2S → S + HBr
Al + HNO3 → Al(NO3)3 + NO2 + …
KI + K2MnO4 + H2O → KIO3 + MnO2 + …
FeCl2 + Br2 → FeCl2Br
NO2 + H2O → HNO3 + NO
ИДЗ «Растворы. Окислительно-восстановительные реакции»
Вариант №12
Сколько граммов вещества следует взять для приготовления 50 мл 1М раствора CsNO3?
Вычислите молярную концентрацию 2,6%-ного раствора тетрабората натрия Na2B4O7 ( ).
Давление пара воды при 20°С составляет 2338 Па. Сколько граммов сахара C12H22O11 следует растворить в 720 г воды для получения раствора, давление пара которого на 18,7 Па меньше давления пара воды?
Написать ионное и молекулярное уравнения гидролиза Na3PO4 и указать реакцию среды раствора. Найти степень гидролиза при концентрации соли = 0,1 моль/л
Во сколько раз растворимость AgClв 0,001 н. растворе NaClменьше, чем в воде?
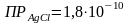 .
.
Определить рН 20%. раствора гидроксида калия.
Определить концентрацию ионов водорода в растворе, рН которого равен 1,5?
Определите рН раствора фосфорной кислоты (считая ее диссоциацию только по первой ступени) с концентрацией 0,05 моль/л. (Ка=7,5 .10-3)
Ток силой 6,7 А пропущен через электролизер с раствором, содержавшим 34,3 г H2SO4. Сколько часов должен длиться электролиз, чтобы масса H2SO4 в растворе достигла 49г?
Закончите составление следующих уравнений и найдите коэффициенты с помощью или схем электронного баланса:
Cl2 + KBr → Br2 + KСl
Al + HNO3 → Al(NO3)3 + NO + ..
HCl + KMnO4 → Cl2 + MnCl2 + …
FeSO4 + Cl2 → FeSO4Cl
Ca(OH)2 + NO2 → Ca(NO2)2 + Ca(NO3)2 + …
ИДЗ «Растворы. Окислительно-восстановительные реакции»
Вариант №13
Вычислите процентное содержание растворенного вещества в растворе, содержащем 60 г нитрата серебра AgNO3 в 750 г воды.
Вычислите молярную концентрацию 5,67%-ного раствора сульфата калия алюминия KAl(SO4)2 (
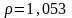 ).
).
Водный раствор глицерина кристаллизуется при температуре -2,79°С. Вычислите число молей глицерина, приходящиеся на каждые 100 г воды, если криоскопическая константа воды равна 1,86°.
Закончите составление следующих уравнений и найдите коэффициенты с помощью или схем электронного баланса:
Cl2 + KI + H2O → KIO3 + KСl + …
Sb + HNO3 → Sb2O5 + NO + …
Na2SO3 + K2Cr2O7 + H2SO4 → Na2SO4 + Cr2(SO4)3 + …
Fe(OH)2 + I2 + KOH → Fe(OH)3 + KI
HClO3 → HClO4 + ClO2 + …
Написать ионное и молекулярное уравнения гидролиза FeCl2 и указать реакцию среды раствора.
Вычислить растворимость (в моль/л) CaF2 в воде и в 0,05 Мрастворе СаС12. Во сколько раз растворимость во втором случае меньше, чем в первом?
 .
.Определить рН 0,01 М. раствора иодоводородной кислоты.
Определить концентрацию ионов водорода в растворе, рН которого равен 0,5?
Определите рН раствора сероводородной кислоты (считая ее диссоциацию только по первой ступени) с концентрацией 0,2 моль/л. (K1=1,1 .10-7)
При какой силе тока можно из водного раствора NaOH выделить 6 л кислорода, измеренных при 17°С и 98 кПа, в течение 3 часов?
