
- •Вариант №1
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №2
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №3
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант № 4
- •Определить концентрацию ионов водорода в растворе, рН которого равен 3,4?
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №5
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Вариант №6
- •Определить концентрацию ионов водорода в растворе, рН которого равен 12,8?
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №7
- •Определить концентрацию ионов водорода в растворе, рН которого равен 8,8?
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №8
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №9
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса
- •Вариант №10
- •В 500 мл воды при 18°с растворяется 0,0166 гAg2CrO4. Чему равно произведение растворимости этой соли?
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Вариант №11
- •Определить концентрацию ионов водорода в растворе, рН которого равен 13,5?
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Вариант №12
- •Определить концентрацию ионов водорода в растворе, рН которого равен 1,5?
- •Вариант №13
- •Определить концентрацию ионов водорода в растворе, рН которого равен 0,5?
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №14
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Вариант №15
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Вариант №16
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Определить концентрацию ионов водорода в растворе, рН которого равен 2,5?
- •Вариант №17
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Во сколько раз растворимость (в моль/л) Fe(oh)2в воде больше растворимости Fe(oh)3 при 25°с? и .
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №18
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Определить концентрацию ионов водорода в растворе, рН которого равен 1,2?
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №19
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
- •Определить концентрацию ионов водорода в растворе, рН которого равен 5,8?
- •Идз «Растворы. Окислительно-восстановительные реакции» Вариант №20
- •Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
Сколько граммов вещества следует взять для приготовления 300 мл 0,3М раствора K2SO3?
Вычислите молярную концентрацию 27,1%-ного раствора хлорида аммония NH4Cl (
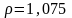 ).
)
).
)Сколько граммов глюкозы C12H22O6 следует растворить в 260 г воды для получения раствора, температура кипения которого превышает температуру кипения чистого растворителя на 0,05°, если эбулиоскопическая константа воды равна 0,52°? )
Написать ионное и молекулярное уравнения гидролиза CuSO4, и указать реакцию среды раствора. Определить степень гидролиза, если концентрация соли равна 0,05 М.
Определить концентрацию ионов водорода в растворе, рН которого равен 12,8?
Как изменится рН воды, если к 150м л ее добавить 0,016 моль HСl?
Определите рН раствора бромноватистой кислоты (HBrO) с концентрацией 0,001 моль/л. (Ka=2,1 .10-9)
Вычислить объем воды, необходимый для растворения при 25 °С 1 гBaSO4.
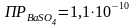 .
.
При какой силе тока можно в течении 15 минут выделить всю медь из 120 мл раствора Cu(NO3)2 с концентрацией 0,2 моль/л
Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
Fe2(SO4)3 + Fe → FeSO4
KI + HNO3 → I2 + NO2 + …
FeSO4 + KMnO4 + KOH → Fe(OH)3 + K2MnO4 + …
SnCl2 + KMnO4 + KOH → H2SnO3 + K2MnO4 + …
NaNO2 + Na2S + H2SO4 → NO + S + …
Идз «Растворы. Окислительно-восстановительные реакции» Вариант №7
Сколько граммов хлорида калия KCl следует растворить в 100 г воды для получения 5%-ного раствора?
Вычислите молярную концентрацию 18%-ного раствора аммиака NH3 (
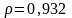 ).
).
Давление пара воды при 25°С составляет 3167 Па. вычислите для этой же температуры давление пара раствора, в 450 г которого содержится 90 г глюкозы C6H12O6.
Написать ионное и молекулярное уравнения гидролиза (NH4)2СO3 и указать реакцию среды раствора. Определить значение рН ,если концентрация соли равна 0,02 моль/л
Найти массу серебра, находящегося в виде ионов в 1 л насыщенного раствора AgBr.
 .
.
Определить концентрацию ионов водорода в растворе, рН которого равен 8,8?
Как изменится рН воды, если к 200мл ее добавить 0,06 моль Ba(OH)2?
Определите рН раствора селеноводородной кислоты H2Se (считая ее диссоциацию только по 1 ступени) с концентрацией 0,3 моль/л. (K1=1,7 .10-4)
Сколько граммов AgNO3 было в растворе, если для выделения всего серебра из этого раствора потребовалось пропускать ток силой в 0,8 А в течении 20 минут?
Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
AgCl + Zn → Ag + …
Na2SO3 + HNO3 → Na2SO4 + NO + …
KI + KMnO4 + H2O → KIO3 + MnO2 + …
FeSO4 + KMnO4 + HCl → FeCl3 + MnSO4 + MnCl2 + …
FeSO4 + H2O2 + H2SO4 → Fe2(SO4)3 + H2O + …
Идз «Растворы. Окислительно-восстановительные реакции» Вариант №8
Сколько граммов растворенного вещества содержит 1 л 1.8M. раствора Al2(SO4)3?
Вычислите молярную концентрацию 98%-ного раствора серной кислоты H2SO4 (
 ).
).
Вычислите осмотическое давление 25%-ного раствора сахара C12H22O11 при 15°С, если его плотность
 .
.Написать ионное и молекулярное уравнения гидролиза Rb2S и указать реакцию среды раствора. Найти степень гидролиза при концентрации соли = 0,02 моль/л
Исходя из произведения растворимости карбоната кальция, найти массу СаСO3, содержащуюся в 100 мл его насыщенного раствора. .
Как изменится рН воды, если к 4 л ее добавить 0,06 моль NaOH?
Определить концентрацию ионов водорода в растворе, рН которого равен 2,8?
Определите рН раствора фтороводородной кислоты с концентрацией 0,8 моль/л. (Ка=6,6 .10-4)
Какова продолжительность электролиза 262,5 г 6%-ного раствора HgCl2 при силе тока в 5,8 А?
Закончите составление следующих уравнений и найдите коэффициенты с помощью схем электронного баланса:
Cl2 + NaNO2 + H2O → NaNO3 + HCl + …
Na2SO3 + HNO3 → Na2SO4 + NO2 + …
H2O2 + KMnO4 → O2 + MnO2 + …
FeSO4 + HNO3 → Fe2(SO4)3 + NO + …
K2Cr2O7 + H2O2 + H2SO4 → Cr2(SO4)3 + O2 + …
