
- •Методические указания к выполнению самостоятельных работ
- •Архангельск
- •Методические указания к выполнению самостоятельных работ
- •Ил.9, Табл.2, Библиогр.3 назв.
- •Термодинамика
- •Основные понятия химической термодинамики
- •2. Тепловой эффект химических реакций. Термохимические расчеты
- •3.Направленность химических реакций
- •II. Кинетика
- •Скорость химической реакции
- •Зависимость скорости реакции от природы реагирующих веществ
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •III. Химическое равновесие
- •Смещение химического равновесия. Принцип Ле Шателье.
- •I. Общие задачи по термодинамике
- •Задачи на расчет тепловых эффектов .
- •III. Задачи на расчет энергии Гиббса.
- •Задачи на правило Вант-Гоффа
- •V. Задачи на определение энергии активации
- •VI. Задачи на определение скорости реакции
- •Задачи на химическое равновесие
- •Приложения
- •Оглавление
- •Термодинамика………………………………………………
Северный (Арктический) Федеральный университет
Имени М.В.Ломоносова
ЭНЕРГЕТИКА И
КИНЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
Методические указания к выполнению самостоятельных работ
Архангельск
2011
Министерство образования и науки Российской Федерации
Федеральное государственное автономное образовательное учреждение высшего профессионального образования
Северный (Арктический) Федеральный университет
Имени М.В.Ломоносова
ЭНЕРГЕТИКА И
КИНЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
Методические указания к выполнению самостоятельных работ
К выполнению самостоятельной работы по химии студентами специальностей 240100.62; 240700.62; 241000.62; 200500.62; 200402; 280100; 280102.65.
Архангельск
2011
Рассмотрены и рекомендованы к изданию методической комиссией Института теоретической и прикладной химии
ФГАОУ Северный (Арктический) Федеральный университет
Имени М.В.Ломоносова
Составители:
Доцент кафедры общей и аналитической химии - Л.В.Майер,
Старший преподаватель кафедры общей и аналитической химии - О.П.Орлова
Рецензент:
Д.Г.Чухчин, доцент, канд. хим. наук
Энергетика и кинетика химических процессов. Методические указания к выполнению самостоятельной работы/ Л.В. Майер, О.П. Орлова. – Архангельск: Северный (Арктический) федеральный университет, 2011. – 40 с., иллюстр.
Методические указания содержат теоретический материал по энергетике, кинетике химических процессов и химическому равновесию. В указаниях приведены примеры термохимических расчетов и упражнения для самостоятельной работы студентов. Методические указания содержат необходимый справочный материал .
Предназначены для студентов 1-го курса специальностей 240100.62; 240700.62; 241000.62; 200500.62; 200402; 280100; 280102.65.
Ил.9, Табл.2, Библиогр.3 назв.
Термодинамика
Термодинамика – наука о превращениях одних видов энергии и работы в другие.
Химическая термодинамика изучает превращения энергии и работы при химических процессах. Знание закономерностей химической термодинамики позволяет:
предсказать, возможно ли в принципе химическое взаимодействие между данными веществами при определенных условиях;
рассчитать количество энергии, которое выделится при проведении реакции или необходимо затратить для ее осуществления;
предсказать, до какой степени будет протекать химическая реакция прежде, чем установиться химическое равновесие при данных условиях;
выбрать оптимальные условия проведения процесса, обеспечивающие получение максимального выхода нужного продукта.
Основные понятия химической термодинамики
Термодинамические системы
Термодинамической системой называется совокупность веществ, находящихся во взаимодействии и мысленно или физически выделенных из окружающей среды.
В зависимости от характера взаимодействия системы с окружающей средой различают открытые, закрытые и изолированные системы.
открытые (незамкнутые) системы могут обмениваться с внешней средой энергией и массой. Например, в результате реакции взаимодействия соды с раствором хлороводородной кислоты улетучивается диоксид углерода и пары воды, то есть масса системы уменьшается, часть выделяющегося тепла идет на обогрев внешней среды: Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
закрытые (замкнутые) системы могут обмениваться с внешней средой только энергией. Например, рассмотренная выше система сода- кислота будет закрытой, если пробирку закрыть пробкой. В этом случае происходит только теплообмен с внешней средой через стенки пробирки;
изолированные системы не обмениваются с окружающей средой ни массой ни энергией. На практике абсолютно изолированных систем не существует. Приближенно изолированной системой будет та же сода- кислота в закрытой пробкой пробирке, помещенная в термос.
Фазой называется часть системы, отделенная от других ее частей хотя бы одной поверхностью раздела. При переходе через поверхность раздела свойства системы меняются скачкообразно (плотность, вязкость, электропроводность, tкип., tплав.). Например, трехфазная система, приведенная на рис.1., включает три фазы и две поверхности раздела.
Р
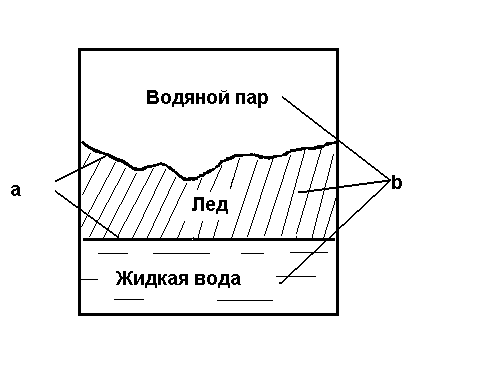 ис.1.Пример
трехфазной системы: a
– поверхности раздела фаз;
ис.1.Пример
трехфазной системы: a
– поверхности раздела фаз;
b – фазы системы.
По агрегатному состоянию фазы разделяются на твердые (т), жидкие (ж) и газообразные (г). Твердые вещества образуют самостоятельные фазы. Жидкости могут смешиваться (серная кислота и вода или бензин и керосин), могут не смешиваться (вода и бензин). Любая смесь газов всегда однофазна.
Гомогенная система состоит из веществ, находящихся в одной фазе, в ней отсутствует поверхность раздела. Гомогенной системой является воздух-смесь азота, кислорода, водорода и других газов. К гомогенным системам относятся раствор серной кислоты, жидкая вода, лед, система 3H2(г)+ N2(г) = 2NH3 (г), состоящая только из газообразных веществ.
Гетерогенная система состоит из веществ, находящихся в разных фазах, разделенных поверхностью раздела. Гетерогенной системой является лед в воде, насыщенный раствор соли в воде, молоко, дым, туман. Система вода – лед - водяной пар – гетерогенная, трехфазная, состоит из жидкой, твердой и газообразной фаз. Система С(графит)+ СО2 (г) = 2СО (г) – гетерогенная, двухфазная, состоит из одной твердой и одной газообразной фаз.
Система MgO(к) + CO2(г) = MgCO3(к) – гетерогенная, трехфазная, состоит из двух твердых (к - кристаллы) и одной газообразной фаз.
Параметры состояния. Термодинамические процессы. Термодинамические функции.
Состояние системы определяется ее параметрами. В химической термодинамике рассматривают термодинамические параметры состояния: давление (P), объем (V), температуру (T) и концентрацию (C). Термодинамические параметры могут быть непосредственно измерены. Набор параметров P, V, T называют состоянием системы.
Изменение состояния системы называется термодинамическим процессом. В зависимости от условий протекания, процессы могут быть:
изохорные - протекают при постоянном объеме системы (V = const);
изобарные - протекают при постоянном давлении (P = const);
изотермические - протекают при постоянной температуре (T = const):
изохорно-изотермические (V = const и T = const);
изобарно-изотермические (Р = const и T = const);
адиабатические (теплота Q = 0), отсутствует теплообмен системы с окружающей средой.
Оценить ход процесса можно по изменению свойств системы или термодинамических параметров. При этом изменяются термодинамические функции, которые характеризуют процесс или состояние системы, т.е. термодинамические функции делятся соответственно на функции процесса и функции состояния.
К функциям процесса относятся теплота Q и механическая работа A, изменение которых зависит от условий и пути протекания процесса.
Теплота Q - это количественная мера хаотического движения частиц системы или тела. Энергия более нагретого тела передается в форме теплоты к менее нагретому. При этом переноса вещества не происходит.
Работа A - это количественная мера энергии, передаваемой от одной системы к другой за счет перемещения вещества под действием каких-либо сил.
К термодинамическим функциям состояния относятся: внутренняя энергия U, энтальпия H, энтропия S, энергия Гиббса G. Изменение этих функций зависит только от начального и конечного системы и не зависит от пути и способа проведения процесса. Величину термодинамических функций относят к 1 моль вещества.
Внутренняя энергия системы. Энтальпия
Один из самых общих законов природы – закон сохранения энергии говорит, что энергия не возникает из ничего и не исчезает, она может лишь превращаться из одного вида в другой. Поэтому в изолированной системе запас энергии постоянен, независимо от протекающих в ней процессов.
Каждая система (тело, вещество, совокупность тел или веществ) обладает определенным запасом внутренней энергии U. Внутренняя энергия системы складывается из кинетической и потенциальной энергии частиц. Кинетическая энергия – это энергия поступательного, колебательного и вращательного движения частиц. Потенциальная энергия обусловлена силами притяжения и отталкивания между частицами. Во внутреннюю энергию системы не входят кинетическая энергия всей системы в целом и потенциальная энергия положения системы.
Внутреннюю энергию системы нельзя измерить. Она представляет собой способность системы к совершению работы или передаче теплоты. Можно определить ее изменение при переходе из начального состояния 1 в конечное состояние 2, т.е.
ΔU = U2 – U1 ,
где U2 и U1 – внутренняя энергия системы в конечном и начальном состояниях.
Так как химический процесс представляет собой превращение одних веществ в другие, запас внутренней энергии системы в ходе химического процесса должен меняться.
Если система получит из внешней среды теплоту Q и перейдет при этом из состояния 1 в состояние 2, то теплота будет расходоваться на изменение внутренней энергии ΔU и совершение системой работы против внешних сил А:
- математическое выражение первого закона термодинамики (частный случай закона сохранения энергии): Q = ΔU + А
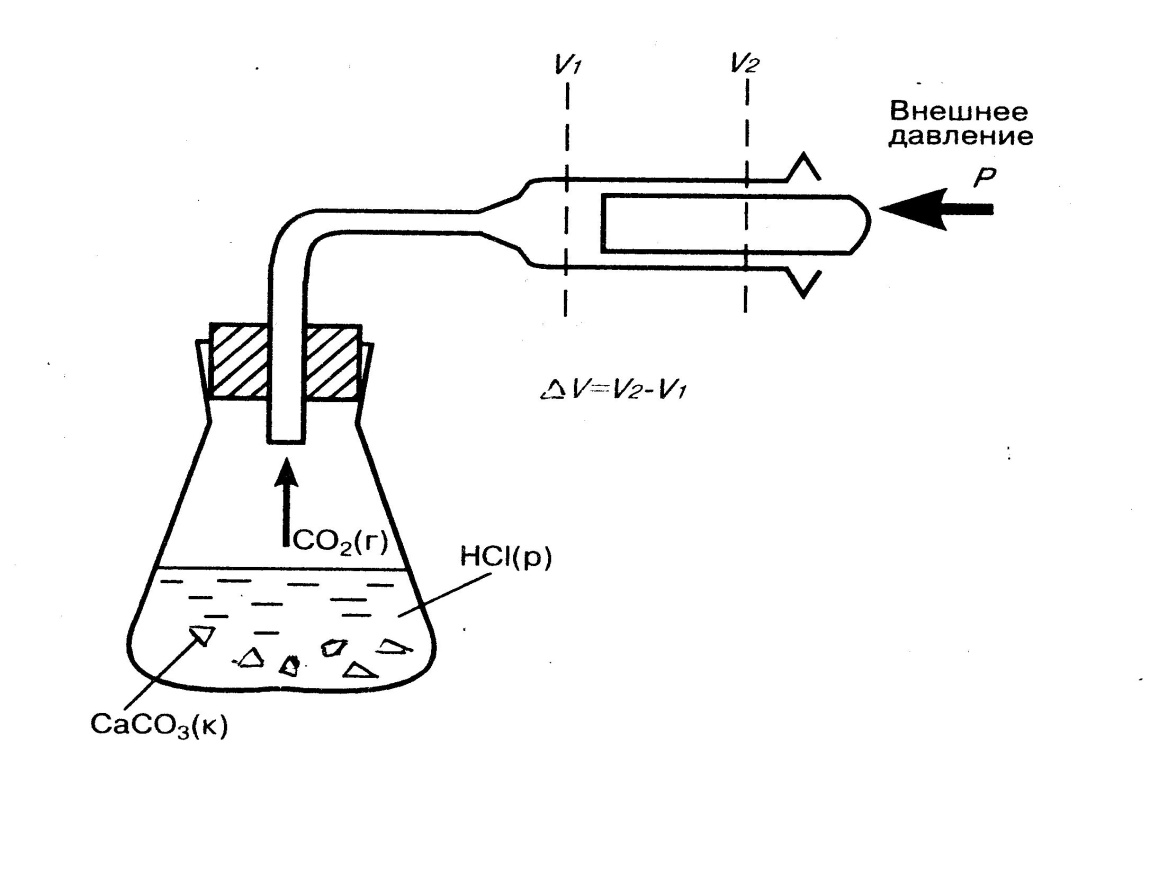
Для химических реакций работой против внешних сил является работа против внешнего давления. Обычно она совершается за счет расширения системы, например, при выделении газа в ходе реакции (рис. 2).
Большинство химических реакций протекает при постоянном давлении (изобарный процесс) в открытом сосуде, поэтому реагирующие вещества могут расширяться. Поскольку увеличению объема системы препятствует внешнее давление Р, система должна совершать работу против внешнего давления:
А = p ΔV, где ΔV = V2 - V1, т.е. А = p(V2 - V1)
Тогда количество теплоты, полученное системой,
Qp = ΔU + pΔV; Qp = (U1 - U2) + p(V2 - V1) = (U2 + pV2) – (U1 + pV1)
Введем обозначение U + pV = Н, тогда
Qp= Н2 - Н1 = ΔН
Величину H = U + pV называют энтальпией.
Энтальпия системы – это теплосодержание или энергосодержание системы, численно она равна сумме внутренней энергии и произведения давления на объем.
Таким образом, для изобарного процесса выделение или поглощение теплоты равно изменению энтальпии системы: Qp = Δ H.
При изохорном процессе (V = const, Δ V = 0) изменения объема системы не происходит. Таким образом, для изохорных процессов теплота, сообщенная системе, расходуется только на изменение внутренней энергии системы:
Qv = U2 – U1= ΔН и, следовательно, изменение энтальпии и изменение внутренней энергии равны ΔН = ΔU.
Рис. 2. Работа системы против внешнего давления
При изотермическом процессе температура системы остается постоянной, значит, изменения внутренней энергии не происходит ΔU = 0. При изотермическом процессе поглощенная теплота расходуется только на совершаемую системой механическую работу: Qt = A = p ΔV.
При адиабатном процессе теплообмена системы с окружающей средой не происходит, ΔQ = 0; тогда механическая работа будет совершаться только за счет убыли внутренней энергии системы: А = – ΔU.
