
- •Практическая работа № 1 строение твердых тел, типы кристаллических структур Ионные кристаллы
- •Молекулярные кристаллы
- •Кристаллографические обозначения атомных плоскостей
- •Решетки Браве
- •Примеры решения задач
- •Геометрия элементарной ячейки
- •Направления решетки. Векторные соотношения.
- •Индексы Миллера – Браве (гексагональные кристаллы).
- •Литература
Практическая работа № 1 строение твердых тел, типы кристаллических структур Ионные кристаллы
Наиболее распространенным примером ионных кристаллов является NaCl, но такой же структурой обладают и множество других кристаллов (например, CaO, FeO, MgO и др). В каждой из этих структур число атомов металла равно числу неметаллических атомов. Кроме того, отношение радиусов ионов таково, что каждый катион могут окружать не более шести анионов 1, 2.
Соединения, содержвщие более крупные катионы, обычно имеют координационное число 8. Для уравновешивания зарядов например в структуре типа АХ2 (например ZrO2, UO2) каждый анион координирован всего лишь с 4 катионами, т.е. лишь половина возможных мест в решетке занята катионами, так что заряды остаются скомпенсированными (рис.1).

Рис. 1. Структурв соединения CaF2. Каждый ион Са2+ координируется с 8 ионами F- , а каждый ион F- координируется лишь с 4 ионами Са2+.
Молекулярные кристаллы
Поскольку молекулы представляют собой устойчивые единицы структуры, то они наподобие атомов могут образовывать кристаллы. Например, метан СН4 при затвердевании образует кристаллы с гранецентрированной кубической (г.ц.к.) структурой. Аналогично г.ц.к. кристаллам аргона и других материалов со слабыми сандерваальсовскими связями, температура плавления метана невелика. Молекулы метана, состоящие из атома углерода и 4 атомов водорода, занимают все узлы в элементарной г.ц.к. ячейке (рис. 2). Так как межмолекулярное притяжение между неполярными молекулами относительно слабое, кристаллизация метана в г.ц.к. структуру не происходит до - 183°С. Но даже в этом случае молекулы СН4 способны вращаться на своих местах в г.ц.к. решетке.

Рис. 2. Молекулярные кристаллы (метан).
Форма двухатомных молекул, таких как О2, N2 и галоиды, не позволяет им координироваться наподобие сфер, поэтому они не образуют кристаллов с кубической структурой.
Ленточные (или цепочечные) молекулы образуют кристаллы, структура которых заметно изменяется по трем направлениям. Примером может служить полиэтилен (рис. 3), при кристаллизации которого молекулярные цепочки из СН2 ориентируются в правильную трехмерную решетку.

Рис. 3. Кристалл полиэтилена из ленточных (цепочечных) молекул.
Так как ленточные молекулы часто состоят из сотен атомов, а межмолекулярные силы вызваны лишь слабым вандерваальсовским, то неудевительно, что при кристаллизации не всегда образуются совершенные кристаллы, как в случае моноатомных твердых тел.
В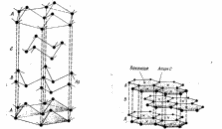 слоистых
структурах
принцип координации выполняется только
в пределах одного слоя, хотя параллельно
располагающиеся слои образуют трехмерную
структуру. Слоистые молекулы также
имеют большие размеры. Примером может
служить мышьяк, «складчатые» слои
которого располагаются один над другим,
повторяясь через каждые 2 слоя; и графита,
который имеет прочные связи внутри
слоев, но слабые связи между отдельными
слоями, поэтому он может применяться
как смазочный материал (рис. 4)
слоистых
структурах
принцип координации выполняется только
в пределах одного слоя, хотя параллельно
располагающиеся слои образуют трехмерную
структуру. Слоистые молекулы также
имеют большие размеры. Примером может
служить мышьяк, «складчатые» слои
которого располагаются один над другим,
повторяясь через каждые 2 слоя; и графита,
который имеет прочные связи внутри
слоев, но слабые связи между отдельными
слоями, поэтому он может применяться
как смазочный материал (рис. 4)
а б
Рис. 4. Кристаллы из слоистых молекул: а – мышьяка; б – графита.
Кристаллические пространственные решетки (рис.5) делят на семь систем – сингоний исходя из соотношения между осевыми единицами и углами.
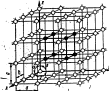
Рис.5. Кристаллическая решетка.
Обозначим ребра ячейки (параллепипеда) через а, b и с, углы между ребрами α, β и γ. Тогда семь кристаллографических систем соответствуют следующим формам ячеек:
триклинная - а ≠ b ≠ с и α ≠ β ≠ γ ≠ 90° ;
моноклинная - а ≠ b ≠ с и α = γ = 90°; β ≠ 90°;
ромбическая - а ≠ b ≠ с и α = β = γ = 90°;
гексагональная - а = b ≠ с и α = β = 90°; γ = 120°;
ромбоэдрическая - а = b = с и α = β = γ ≠ 90°;
тетрагональная - а = b ≠ с и α = β = γ = 90°;
кубическая - а = b = с и α = β = γ = 90°.
Кристаллические решетки, в которых на долю одной элементарной ячейки приходится один атом, называют простыми. Решетки, в которых на долю одной элементарной ячейки приходится несколько атомов, называют сложными.
П одавляющее
число технически важных металлов
образуют одну из следующих высокосимметричных
сложных решеток с плотной упаковкой
атомов: кубическую обьемноцентрированную
(о. ц. к.), кубическую гранецентрированную
(г. ц. к.) и гексагональную (г. п. у.) (рис.
6).
одавляющее
число технически важных металлов
образуют одну из следующих высокосимметричных
сложных решеток с плотной упаковкой
атомов: кубическую обьемноцентрированную
(о. ц. к.), кубическую гранецентрированную
(г. ц. к.) и гексагональную (г. п. у.) (рис.
6).

Рис. 6. Кристаллические решетки металлов и схемы кпаковки атомов: а – обьемноцентрированная кубическая (о. ц. к.); б – гранецентрированная кубическая (г. ц. к.); в – гексагональная плотноупакованная (г. п. у).
О. ц. к. решетку имеют металлы: Rb, K, Na, Li, Tiβ, Zrβ, Ta, Feα, Mo, W, V, Bа и др.
В г. ц. к. решетке атомы расположены в углах куба и в центре каждой грани.
Этот тип решетки имеют металлы: Caα, Ce, Srα, Th, Pb, Ni, Ag, Au, Pd, Pt, Rh, Ir, Feγ, Cu и др.
В гексагональной плотноупакованной решетке атомы расположены в углах и центре шестигранных оснований призмы и три атома в средней плоскости призмы.
Эту упаковку атомов имеют металлы: Hfα, Mg, Tiα, Cd, Re, Os, Ru, Zn, Coα, Be, Tiα, Zrα и др.
Некоторые атомы ( Snβ, In) имеют тетрагональную решетку.


Рис.7. Схема, показывающая число атомов, находящихся на равном и наименьшем расстоянии от атома А в разных кристаллографических решетках: а – К8; б – К12 и в – Г12.
В кубической обьемноцентрированной элементарной ячейке наименьшее расстояние между атомами соответствует d = 0,5а√3. На этом расстоянии от данного атома находятся 8 соседей (рис. 7). Следовательно координационное число для этой решетки соответствует 8 и обозначается К8. Коэффициент заполнения ячейки, определяемый как отношение обьема, занятого атомами, к обьему решетки ячейки, составляет 68% и т.д.
