
- •Применение азотной кислоты.
- •III. Способы производства.
- •IV. Химическая модель данного процесса.
- •V. Технологическая модель.
- •V.I Производство азотной кислоты по схеме ак-72.
- •Применение азотной кислоты.
- •III. Способы производства.
- •IV. Химическая модель данного процесса.
- •V. Технологическая модель.
- •V.I Производство азотной кислоты по схеме ак-72.
Реферат на тему:
«Производство азотной кислоты»
Выполнила: Червоногородская Екатерина
Ярославль, 2012
Оглавление
Введение……………………………………………………………………………………………………….3
Применение азотной кислоты………………………………………………………………………………3
Сырьевая база………………………………………………………………………………………………...3
Способы производства……………………………………………………………………………………….4
Химическая модель процесса……………………………………………………………………………….4
Технологическая модель……………………………………………………………………………………..5
Аппаратурное оформление…………………………………………………………………………………..7
Хранение и транспортировка…………………………………………………………………………………8
Отходы и их утилизация……………………………………………………………………………………….8
Список использованной литературы………………………………………………………………………...9
Введение
Азотная кислота является одной из важнейших минеральных кислот и по объему производства занимает второе место после серной кислоты. Она образует растворимые в воде соли (нитраты), обладает нитрующим и окисляющим действием по отношению органических соединений в концентрированном виде пассивирует черные металлы. Все это обусловило широкое использование азотной кислоты в народном хозяйстве и оборонной технике.
HNO3 — сильная одноосновная кислота.
Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C с частичным разложением. Растворимость азотной кислоты в воде не ограничена. Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной кислотой», с массовой долей 0,6-0,7 — концентрированной азотной кислотой. С водой образует азеотропную смесь (массовая доля 68,4 %, d20 = 1,41 г/см, Tкип = 120,7 °C).
Твёрдая азотная кислота образует две кристаллические модификации:
моноклинная, пространственная группа P 21/a, a = 1,623 нм, b = 0,857 нм, c = 0,631, β = 90°, Z = 16;
ромбическая
Применение азотной кислоты.
Важнейшие области применения азотной кислоты – производство азотных и комбинированных удобрений, взрывчатых веществ (тринитротолуола и др.), органических красителей.
В органическом синтезе широко применяют смесь концентрированной азотной и серной кислоты – «нитрующую смесь».
Азотную кислоту используют в камерном способе производства серной кислоты, для получения фосфорной кислоты из фосфора, как окислитель ракетного топлива.
В металлургии азотную кислоту применяют для травления и растворения металлов, а также для разделения золота и серебра.
Военная промышленность применяет кислоту при изготовлении взрывчатых веществ. В фотографии с помощью HNO3 подкисляют тонирующие растворы, в полиграфии она предназначена для травления печатных форм.
В быту используется только в виде разбавленных растворов для чистки изделий, в первую очередь из благородных металлов. [1]
II. Сырьевая база. Основным сырьем для производства неконцентрированной азотной кислоты в настоящее время являются аммиак, воздух и вода. Вспомогательными материальными и энергетическими ресурсами являются катализаторы окисления аммиака и очистки выхлопных газов, природный газ, пар и электроэнергия.
Синтетический аммиак в большей или меньшей степени загрязнен примесями. Такими примесями являются катализаторная пыль, смазочное масло (при сжатии поршневым компрессором). Для получения чистого газообразного аммиака служат испарительные станции и дистилляционные отделения жидкого аммиака. Дальнейшая очистка осуществляется в фильтрах, состоящих из чечевицеобразных элементов, фильтрующим материалом в которых служит хлопчатобумажная замша. Тонкой очистке аммиачно–воздушная смесь подвергается в фильтре с поролитовыми трубками.
Атмосферный воздух, применяемый в производстве азотной кислоты, забирается на территории завода или вблизи его. Этот воздух загрязнен газообразными примесями и пылью. Поэтому он подвергается тщательной очистке во избежание отравления катализатора окисления аммиака. Очистка воздуха осуществляется, как правило, в скруббере, орошаемом водой, затем в двухступенчатом фильтре.
Вода, применяемая для технологических нужд, подвергается специальной подготовке: отстою от механических примесей, фильтрованию и химической очистке от растворенных в ней солей. Для получения реактивной азотной кислоты требуется чистый паровой конденсат, который дополнительно очищают от возможных примесей. [2]
III. Способы производства.
Существуют
два способа производства азотной
кислоты:
—
получение разбавленной кислоты с
последующим концентрированием ее в
случае необходимости и
—
непосредственное получение концентрированной
кислоты.
Наиболее
распространен первый способ, что связано
с использованием в народном хозяйстве
как концентрированной, так и разбавленной
кислоты. Методы различаются
физико-химическими закономерностями
протекающих процессов и
технологическими схемами. Однако
независимо от схемы, синтез азотной
кислоты из аммиака описывается общей
химической схемой:
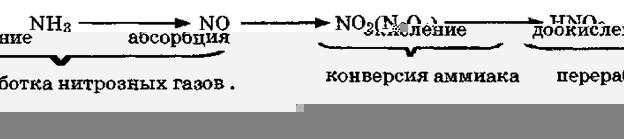 Первая
стадия процесса (конверсия
аммиака) одинакова как для получения
разбавленной, так и для получения
концентрированной кислоты, вторая
стадия (переработка нитрозных газов)
отличается рядом особенностей. Решающее
значение при выборе параметров той или
иной технологической схемы имеет выбор
оптимального
давления на каждой из стадий процесса.
В производстве азотной кислоты повышение
давления существенно интенсифицирует химические
реакции на
всех стадиях процесса, способствует
эффективности теплообмена, позволяет
использовать более совершенные
массообменные устройства, уменьшает
размеры аппаратуры и коммуникаций и, в
конечном итоге, позволяет снизить
капитальные расходы.
В
то же время повышение давления оказывает
и негативное влияние на экономические
показатели работы агрегата.
К ним относятся: ускорение побочных
реакций на стадии окисления аммиака,
снижение степени конверсии, потери
катализатора вследствие его уноса
потоком газа и необходимость частой
замены его, что связано с остановкой
производства.
Технико-экономический
анализ показывает, что применение
единого (повышенного) давления на всех
стадиях производства целесообразно
лишь в том случае, когда мощность
установки не превышает 600—800 т/сутки.
Установки большей мощности экономически
выгодно создавать только с использованием
разных давлений на стадии конверсии
аммиака и стадии переработки нитрозных
газов.
Первая
стадия процесса (конверсия
аммиака) одинакова как для получения
разбавленной, так и для получения
концентрированной кислоты, вторая
стадия (переработка нитрозных газов)
отличается рядом особенностей. Решающее
значение при выборе параметров той или
иной технологической схемы имеет выбор
оптимального
давления на каждой из стадий процесса.
В производстве азотной кислоты повышение
давления существенно интенсифицирует химические
реакции на
всех стадиях процесса, способствует
эффективности теплообмена, позволяет
использовать более совершенные
массообменные устройства, уменьшает
размеры аппаратуры и коммуникаций и, в
конечном итоге, позволяет снизить
капитальные расходы.
В
то же время повышение давления оказывает
и негативное влияние на экономические
показатели работы агрегата.
К ним относятся: ускорение побочных
реакций на стадии окисления аммиака,
снижение степени конверсии, потери
катализатора вследствие его уноса
потоком газа и необходимость частой
замены его, что связано с остановкой
производства.
Технико-экономический
анализ показывает, что применение
единого (повышенного) давления на всех
стадиях производства целесообразно
лишь в том случае, когда мощность
установки не превышает 600—800 т/сутки.
Установки большей мощности экономически
выгодно создавать только с использованием
разных давлений на стадии конверсии
аммиака и стадии переработки нитрозных
газов.
Основные схемы производства азотной кислоты.
1. Производство азотной кислоты по схеме АК-72. (60%)
2. Производство слабой азотной кислоты под повышенным давлением. (53-58%)
3. Производство концентрированной азотной кислоты прямым синтезом из оксидов азота. (98%)
4. Концентрирование азотной кислоты с помощью нитрата магния.
5. Технологическая схема производства азотной кислоты под давлением 0,7 МПа. (55-58%) [3]
