
- •1. Методика отримання плівок термовакуумним методом.
- •Хід роботи:
- •1.2. Методи визначення товщини плівок
- •1.2.1 Метод зважування
- •1.2.2 Метод навіски
- •Резистивний метод.
- •1.2.4 Радіочастотний метод контролю товщини плівок.
- •2. Одержання плівок методом катодного розпилення
- •2.1 Схема пристрою для катодного розпилення
- •3. Одержання плівок методом магнетронного розпилення
- •4. Одержання плівок електролітичним методом
- •Дорівнює 2,010 в, що значно перевищує стандартний потенціал окислювання води (1,228 в). Стандартний потенціал окислювання іона f- має ще більше значення (2,87 в).
- •У ряді стандартних електродних потенціалів. Ця аномалія зв'язана зі значною перенапругою другого із цих двох електродних процесів - матеріал анода викликає гальмуючу дію на процес виділення кисню.
- •5. Дослідження товщины плівок виміром опору.
- •6. Дослідження товщины плівок виміром емності.
Дорівнює 2,010 в, що значно перевищує стандартний потенціал окислювання води (1,228 в). Стандартний потенціал окислювання іона f- має ще більше значення (2,87 в).
При електролізі водяних розчинів безкисневих кислот й їхніх солей (крім HF і фторидів) в аноді розряджаються аніони. Зокрема, при електролізі розчинів HI,HBr,HCl й їхніх солей в аноді виділяється відповідний галоген. Відзначимо, що виділення хлору при електролізі HCl й її солей суперечить взаємному положенню систем:
2Cl- =2Cl + 2e- (φ=1,359 В)
і 2Н2О =О2 + 4Н+ + 4е- (φ =1,228 В)
У ряді стандартних електродних потенціалів. Ця аномалія зв'язана зі значною перенапругою другого із цих двох електродних процесів - матеріал анода викликає гальмуючу дію на процес виділення кисню.
У випадку активного анода число конкуруючих окисних процесів зростає до трьох: електрохімічне окислювання води з виділенням кисню, розряд аніона (тобто його окислювання) і електрохімічне окислювання металу анода (так називане анодне розчинення металу). Із цих можливих процесів буде йти той, котрий енергетично найбільш вигідний. Якщо метал анода розташований у ряді стандартних потенціалів раніше обох інших електрохімічних систем, то буде спостерігатися анодне розчинення металу. У противному випадку буде йти виділення кисню або розряд аніона.
Розглянемо кілька типових випадків електролізу водяних розчинів.
Електроліз розчину CuCl2 з інертним анодом. Мідь у ряді напруг розташована після водню; тому на катоді буде відбуватися розряд іонів Cu2+ і виділення металевої міді. В аноді будуть розряджатися хлорид-іони.
Схема електролізу розчину хлориду мели (II):
CuCl2
Катод ← Cu2+ 2Cl- → Анод
Cu2+ + 2e- =Cu 2Cl- =2Cl + 2e-
2Cl=Cl2
Електроліз розчину K2SO4 з інертним анодом. Оскільки калій у ряді напруг знаходиться значно раніше водню, то на катоді буде відбуватися виділення водню й нагромадження ОН-. На аноді буде йти виділення кисню й нагромадження іонів Н+. У той же час у катодний простір будуть приходити іони К+, а в анодн-іони SO42- . Таким чином, розчин у всіх його частинах буде залишатися електронейтральним. Однак у катодному просторі буде накопичуватися луг, а на аноді - кислота.
Схема електролізу розчину сульфату калію:
2K2SO4
Катод ← 4K+ 2SO42- → Анод
4K+ 2SO42-
4Н2О + 4е- =4ОН- + 4Н 2Н2О=4Н+ + 2О + 4e-
KОН 4Н=2Н2 2О=О2 Н2SO4
Електроліз розчину NiSO4 з нікелевим анодом. Стандартний потенціал нікелю (-0,250 В) трохи більше, ніж –0,41 В; тому при електролізі нейтрального розчину NiSO4 на катоді в основному відбувається розряд іонів Ni2+ і виділення металу. На аноді відбувається протилежний процес - окислення металу, тому що потенціал нікелю набагато менше потенціалу окислювання води, а тим більше-потенціалу окислювання іона SO42- . Таким чином, у цьому випадку електроліз зводиться до розчинення металу анода й виділенню його на катоді.
Схема електролізу розчину сульфату нікелю:
NiSO4
Катод ← Ni2+ SO42- → Анод
SO42-
Ni2+ + 2e- =Ni Ni=Ni2+ + 2e-
Цей процес застосовується для електрохімічного очищення нікелю.
В якості ще одного прикладу розглянемо процес електролізу при пропусканні електричного струму через розчин мідного купоросу CuSO4 з опущеними в нього мідними електродами.
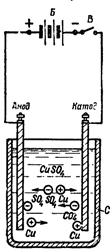
Рис.4.1 Явище електролізу при проходженні струму через розчин мідного купоросу : C - посудина з електролітом, Б - джерело струму, В – вимикач.
Тут також буде зустрічний рух іонів до електродів. Позитивним іоном буде іон міді (Сі), а негативним - іон кислотного залишку (SO4). Іони міді при зіткненні з катодом розряджатимуться (приєднуючи до себе бракуючі електрони), т. е. перетворюватися на нейтральні молекули чистої міді, і у вигляді щонайтоншого (молекулярного) шару відкладатися на катоді.
Негативні іони, досягнувши анода, також розряджаються (віддають зайві електрони). Але при цьому вони вступають в хімічну реакцію з міддю анода, внаслідок чого до кислотного залишку SO4 приєднується молекула міді Сu і утворюється молекула мідного купоросу СuSО4, повертана назад електроліту.
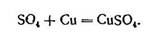
Оскільки цей хімічний процес протікає тривалий час, то на катоді відкладається мідь, що виділяється з електроліту. При цьому електроліт замість молекул міді, що пішли на катод, отримує нові молекули міді за рахунок розчинення другого електроду - анода.
Той же самий процес відбувається, якщо замість мідних узяті цинкові електроди, а електролітом служить розчин цинкового купоросу ZnSO4. Цинк також переноситиметься з анода на катод.
Таким чином, різниця між електричним струмом в металах і рідких провідниках полягає в тому, що в металах переносниками зарядів є тільки вільні електрони, т. е. негативні заряди, тоді як в електролітах електрика переноситься різнойменно зарядженими частками речовини - іонами, що рухаються в протилежних напрямах.


I = 10 мA, t = 30 хв, S1 = 630 мм2, S2 = 567 мм2
До електролізу:
m11 (+) = 10,2875 г,
m21 (-) = 10,2227 г.
Після електролізу:
m12 (+) = 10,2811 г,
m22 (-) = 10,2278 г.
Товщину плівки можна розрахувати за формулою:
![]()
де Δm – зміна маси пластини, S – площа пластини, ρ(м) – щільність міді.
Зміну маси пластини можна знайти за формулою:
![]()
де
Q
– кількість електричного струму (![]() ),
),
![]()
M – молярна маса матеріала, Na – стала Авогадро, z – валентність матеріалу, e – заряд електрона.
Звідси кінцева формула для вызначення товщини плівки буде мати вигляд:
![]()
Товщина плівки одержана на катоді:
![]()
Товщина плівки на аноді:
![]()
