
- •1. Качественный анализ катионов
- •1.1. Аналитическая классификация катионов
- •1. 2. Классификация анионов и групповые реагенты
- •Классификация анионов
- •Конфигурацией атомов и ионов
- •1. 3. Кислотно-основная схема проведения анализа смеси катионов
- •Анализ смеси катионов I группы.
- •1. 3. 2. Аналитические реакции катионов II аналитической группы
- •1. 3. 3. Аналитические реакции катионов III аналитической группы
- •1. 3. 4. Аналитические реакции катионов IV аналитической группы
- •Анализ смеси ионов IV аналитической группы.
- •Анализ смеси ионов V аналитической группы.
- •Анализ смеси ионов VI аналитической группы.
- •2. Качественный анализ анионов
- •2. 1. Аналитическая классификация анионов
- •2. 1. 1. Аналитические реакции анионов I аналитической группы (Сl-, Вr-, I-, s2-, no2-, no3-)
- •Диализ смеси анионов I аналитической группы.
- •2. 1. 2. Аналитические реакции анионов II аналитической группы (sо42-, sо32-, s2о32-, со32-, ро43- АsО43-, АsО33-)
- •Анализ смеси анионов II аналитической группы.
- •2. 2. Заключение
- •3. Качественный анализ неизвестного вещества
- •3.1. Применение экстракции в качественном анализе
- •3.2. Анализ смеси ионов с применением хроматографии
- •3.3. Предварительные испытания и подготовка вещества к анализу. Перевод вещества в раствор
- •4. Основы качественного анализа органических соединений
- •4.1. Принципы идентификации органического соединения
- •4.2. Качественный элементный анализ
- •4.3. Качественный функциональный анализ
1. 3. 3. Аналитические реакции катионов III аналитической группы
(Са2+, Sr2+, Ва2+, Pb2+)
Реакции катионов Са2+.
Реакция с серной кислотой:
CaCl2 + H2SO4 = CaSO4 + 2HCl (ПР CaSO4 = 2.37 * 10-5) (4.27)
Белый осадок выпадает только в сравнительно концентрированных растворах. Эту реакцию лучше выполнять в микрокристаллоскопическом варианте. Для этого на предметное стекло помещают по капле исследуемого раствора и разбавленной Н2SО4 и слегка упаривают до появления каемки по краям капли. После охлаждения раствора наблюдают под микроскопом характерные собранные в пучки игольчатые кристаллы гипса — СаSО4 • 2Н2О (рис. 4.4).
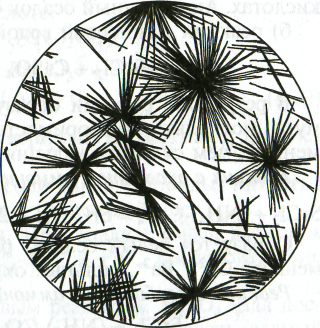
Рис. 4.4. Кристаллы СаSО4 • 2Н2О
Реакция с оксалатом аммония (NН4)2С2О4:
СаСl2 + (NН4)2С2О4 = СаС2О4 + 2NН4Сl (ПР СаС2О4 = 2,3 • 10-9). (4.28)
В результате реакции образуется белый мелкокристаллический осадок. Аналогичные осадки получаются с ионами Sr2+ и Ва2+. Сильные окислители (КМnО4, К2Сr2О7, Сl2 и др.) мешают проведению реакции.
Реакция с гексацианоферратом (II) калия (желтой кровяной солью) К4[Fе(СN)6]:
СаСl2 + 2NН4Сl + К4[Fе(СN)6] = Са(NН4)2[Fе(СN)6] + 4КСl (4.29)
Реакцию проводят в присутствии аммонийного буферного раствора (рН = 9), при этом образуется белый кристаллический осадок нерастворимый в уксусной кислоте (отличие от Sr2+).
Реакция с карбонатом аммония (NН4)2СО3:
СаСl2 + (NН4)2СО3 = СаСО3 + 2NН4Сl (ПРСаСОз = 3,8 • 10-7). (4.30)
В результате реакции образуется белый мелкокристаллический осадок. Похожие осадки образуют ионы Sr2+ и Ва2+. Осадок легко растворим в уксусной кислоте. Оптимальное значение рН = 9,2. При рН > 10,4 начинается осаждение (МgОН)2СО3.
Окрашивание пламени: соли кальция окрашивают бесцветное пламя горелки в кирпично-красный цвет.
Реакции катионов Sr2+.
Осаждение сульфата стронция SrSО4:
а) реакция с серной кислотой и растворимыми сульфатами
SrСl2 + Н2SО4 = SrSО4 + 2НСl (ПР SrSО4 = 3,2 • 10-7). (4.31)
Выпадающий мелкокристаллический осадок нерастворим в кислотах. Аналогичный осадок образует ион Ва2+;
б) реакция с гипсовой водой (водным раствором СаSО4):
SrСl2 + СаSО4 = SrSО4 + СаСl2 (4.32)
В результате реакции образуется осадок SгSО4 в виде легкой мути, поскольку растворимость сульфата стронция значительно меньше, чем сульфата кальция.
Реакция с оксалатом аммония (NН4)2С2О4:
SrСl2 + (NН4)2С2О4 = SrC2O4 + 2NH4Cl (ПР SrC2O4 = 1.6 * 10-7) (4.33)
Образуется белый осадок, растворимый в кислотах. Реакции мешают Са2+, Ва2+, сильные окислители.
Реакция с карбонатом аммония (NН4)2СО3:
SrСl2 + (NН4)2СО3 = SrСО3 + 2NH4Сl (ПР SrСО3= 1.1 * 10-10). (4.34)
Образуется белый осадок, растворимый в кислотах. Реакции мешают Са2+, Ва2+.
Окрашивание пламени: соли стронция окрашивают пламя в характерный яркий карминово-красный цвет.
Реакции катионов Ва2+.
Реакция с серной кислотой и растворимыми сульфатами:
ВаСl2 + Н2SO4 = ВаSO4 + 2НСl (ПРВаS04 = 1,1 • 10-10). (4.35)
Образуется белый кристаллический осадок белого цвета нерастворимый в кислотах. Перевод в раствор ВаSО4 возможен путем превращения его в ВаСО3, который затем растворяют в кислоте. Практически это превращение выполняют нагреванием ВаSО4 с насыщенным раствором Nа2СО3.
Реакция с дихроматом калия К2Сг2О7:
2ВаСl2 + К2Сr2О7 = 2ВаСrО4 + 4КСl (ПР ВаСrО4=1,2 * 10-10). (4.36)
Образуется желтый кристаллический осадок ВаСrО4, растворимый в сильных кислотах, но нерастворимый в разбавленной уксусной кислоте (рН > 2,7). Образование ВаСrО4 возможно, поскольку в результате существования равновесия
Сr2O72-+ Н2О = 2НСrО4 = 2СrO42- + 2Н+ (4.37)
образуются ионы СrО42-, концентрация которых при рН > 2,7 становится достаточной для достижения ПР ВаСrО4 = 1,2-10-10 ([Сr2О72-] = 1М при [Ва2+] = 10-5М ).
Реакция с оксалатом аммония (NН4)2С2О4:
ВаСl2 + (NН4)2С2О4 = ВаС2О4 + 2NН4Сl (ПР ВаС2О4 =1.2 * 10-7). (4.38)
Образуется белый осадок, растворимый в сильных кислотах, а при нагревании — в уксусной кислоте.
Реакция с карбонатом аммония (NН4)2СО3:
ВаСl2 + (NН4)2СО3 = ВаСО3 + 2NH4Сl (ПР ВаСО3= 4,0.10-10). (4.39)
Образуется белый осадок, растворимый в кислотах с выделением пузырьков газа СО2.
Окрашивание пламени: летучие соли бария (хлориды, нитраты) окрашивают бесцветное пламя в желто-зеленый цвет.
Анализ смеси ионов III группы.
При анализе смеси катионов III группы, содержащей Са2+, Sr2+, Ва2+ и Pb2+, последовательно выполняют следующие операции:
• осаждение сульфатов групповым реагентом Н2SО4 (для достижения полноты осаждения СаSО4 следует добавлять равный объем С2Н5ОН) [см. (4.27), (4.31), (4.35)];
• перевод сульфатов в карбонаты многократной обработкой осадка избытком карбоната натрия при нагревании;
• перевод ионов свинца в сульфид добавлением Na2S;
• растворение осадка карбонатов в уксусной кислоте;
• открытие и отделение ионов бария в виде ВаСrО4 (с помощью К2Сr2О7 + СНзСООNа) [см. (4.36)];
• растворение карбонатов и отделение сульфата стронция добавлением СН3СООН + (NN4)2SO4 при нагревании;
• открытие ионов кальция в виде СаС2О4 с помощью оксалата аммония (NН4)2С2О4 [уравнение (4.28)].
Применение в медицине. В медицинской и фармацевтической практике применяют соли кальция и бария. Сульфат кальция или гипс применяют для наложения гипсовых повязок. Хлорид кальция, глюконат кальция используют при аллергических заболеваниях, как кровоостанавливающее средство при пониженной свертываемости крови. Карбонат кальция, мел, способен снижать повышенную кислотность желудочного сока и входит в состав зубных порошков и паст. Соединения кальция играют важную роль в организме человека, входя в качестве основных частей в состав костей, тканей, крови. Они регулируют деятельность системы свертывания крови, нервные и иммунные процессы, работу сердца.
