
- •1. Качественный анализ катионов
- •1.1. Аналитическая классификация катионов
- •1. 2. Классификация анионов и групповые реагенты
- •Классификация анионов
- •Конфигурацией атомов и ионов
- •1. 3. Кислотно-основная схема проведения анализа смеси катионов
- •Анализ смеси катионов I группы.
- •1. 3. 2. Аналитические реакции катионов II аналитической группы
- •1. 3. 3. Аналитические реакции катионов III аналитической группы
- •1. 3. 4. Аналитические реакции катионов IV аналитической группы
- •Анализ смеси ионов IV аналитической группы.
- •Анализ смеси ионов V аналитической группы.
- •Анализ смеси ионов VI аналитической группы.
- •2. Качественный анализ анионов
- •2. 1. Аналитическая классификация анионов
- •2. 1. 1. Аналитические реакции анионов I аналитической группы (Сl-, Вr-, I-, s2-, no2-, no3-)
- •Диализ смеси анионов I аналитической группы.
- •2. 1. 2. Аналитические реакции анионов II аналитической группы (sо42-, sо32-, s2о32-, со32-, ро43- АsО43-, АsО33-)
- •Анализ смеси анионов II аналитической группы.
- •2. 2. Заключение
- •3. Качественный анализ неизвестного вещества
- •3.1. Применение экстракции в качественном анализе
- •3.2. Анализ смеси ионов с применением хроматографии
- •3.3. Предварительные испытания и подготовка вещества к анализу. Перевод вещества в раствор
- •4. Основы качественного анализа органических соединений
- •4.1. Принципы идентификации органического соединения
- •4.2. Качественный элементный анализ
- •4.3. Качественный функциональный анализ
1. 3. Кислотно-основная схема проведения анализа смеси катионов
1. 3. 1. Аналитические реакции катионов I аналитической группы (Na+,К+, NH4+)
Реакции катионов калия.
Реакция с гексанитрокобалътиатом(III) натрия Nа3[Со(NО2)6]:
2КСl + Nа3[Со(NО2)6] = К2Nа[Со(NО2)6] + 2NаСl (4.1)
При добавлении двух-трех капель реактива к такому же количеству раствора соли калия образуется желтый кристаллический осадок. Реакцию следует проводить в слабокислой среде (рН = 3…5), в отсутствие ионов аммония, сильных окислителей и восстановителей.
Реакция с гидротартратом натрия NаНС4Н4О6:
(4.2)
К двум-трем каплям исследуемого раствора добавляют раствор Реактива, затем следует потереть стеклянной палочкой о стенки пробирки. Через некоторое время появляется белый кристаллический осадок калиевой соли. Реакцию проводят при рН - 5...7 в холодном растворе. Ионы аммония мешают проведению реакции. Реакция малочувствительна.
Реакция с тетрафенилборатом натрия Na[В(С6Н5)4]:
КСl + Nа[В(С6Н5)4] = К[В(С6Н5)4] + NаСl (4.3)
При смешении растворов образуется объемистый мелкокристаллический осадок белого цвета нерастворимый в разбавленных кислотах. Реакция весьма чувствительна. Ионы аммония мешают проведению реакции.
Микрокристаллоскопическая реакция с гексанитрокупратом натрия и свинца Nа2Pb[Сu(NО2)6]:
2КСl + Nа2Pb[Сu(NО2)6] = К2Pb[Сu(NО2)6] + 2NаСl (4.4)
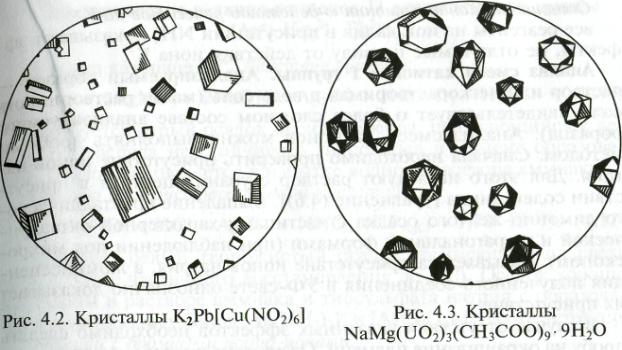
Реакцию проводят на предметном стекле: каплю исследуемого раствора подсушите на водяной бане, и добавьте каплю раствора тройного нитрита. В присутствии ионов калия под микроскопом видны характерные черные кубические кристаллы К2Pb[Сu(NО2)6] (рис. 4.2).
Окрашивание пламени соединениями калия: проба проводится в пламени газовой горелки. Для этого небольшую порцию исследуемого раствора или твердого вещества на чистой нихромовой или алюминиевой проволоке вносят в пламя горелки. В присутствии соединений калия пламя окрашивается в фиолетовый цвет. Соединения натрия мешают проведению опыта. Для устранения его влияния пламя горелки следует рассматривать через синий стеклянный фильтр (кобальтовое стекло).
Реакции ионов натрия.
Реакция с гексагидроксиантимонатом (V) калия - К[Sb(ОН)6]:
NаСl + К[Sb(ОН)6] = Nа[Sb(ОН)6] + КСl (4.5)
После добавления раствора реактива к исследуемому раствору следует потереть стеклянной палочкой стенки пробирки. При этом образуется белый кристаллический осадок натриевой соли. Его следует отличать от аморфного осадка метасурьмяной кислоты (НSbО3), которая может выпасть в осадок при рН < 7. Реакция малочувствительна. Ионы аммония и ионы других аналитических групп мешают.
Реакция с уранилацетатом UO2(СН3СОО)2:
СН3СОONa + UO2(СН3СОО)2 = Nа UO2(СН3СОО)3 (4.6)
В присутствии ионов натрия в нейтральной среде образуется лимонно-желтый крупнокристаллический осадок. Реакция специфична. Соединение легко образует пересыщенные растворы, поэтому осадок образуется только через несколько минут. Если проводить реакцию в присутствии ионов Zn2+ или Мg2+, то она идет быстро с образованием желтых осадков тройных солей, например, NaZn(UO2)3(СН3СОО)9- 9Н2О, NаМg(UO2)3(СН3СОО)9 9Н2О соответственно. При наблюдении кристаллов в микроскоп видны правильные тетраэдры и октаэдры (рис. 4.3). Полученные осадки обладают сильной люминесценцией в УФ-свете.
Окрашивание пламени соединениями натрия: проба проводится в пламени газовой горелки. Для этого небольшую порцию исследуемого раствора или твердого вещества с помощью чистой нихромовой или алюминиевой проволоки вносят в пламя горелки. В присутствии соединений натрия пламя окрашивается в ярко-желтый цвет. Проба очень чувствительна, поэтому для предотвращения ошибки следует проверить чистоту всех инструментов.
Реакции ионов аммония.
Реакции с едкими щелочами NаОН и КОН:
NН4Сl + NаОН = NН3 + NaСl + H2O (4.7)
Едкие щелочи при нагревании выделяют из растворов солей аммония газообразный аммиак, который может быть обнаружен не только по характерному запаху, но и другими способами, например, с помощью влажной фильтровальной бумаги, пропитанной раствором фенолфталеина. В присутствии газообразного аммиака индикаторная бумага краснеет.
Действие реактива Несслера |К2[HgI4] + КОН}:
(4.8)
В присутствии солей аммония образуется характерный красно-бурый осадок. Малые количества солей аммония дают желто-оранжевое или желтое окрашивание. Реакция очень чувствительна. Возможно пожелтение раствора от действия аммиака, содержащегося в воздухе. Реакции мешают катионы, образующие окрашенные гидроксиды.
Отношение ионов аммония к действию реагентов на К+: все реагенты на ион калия в присутствии NН4+ показывают эффекты, не отличимые по виду от действия иона К+.
