
- •Методи лабораторних досліджень
- •Мікроскопічні методи дослідження мікроорганізмів
- •Виготовлення мазків і методи їх забарвлення. Прості методи забарвлення.
- •Основні види барвників, що застосовуються в мікробіологічній практиці:
- •Прості способи забарвлення бактерій
- •Складні методи забарвлення.
- •Вирощування мікроорганізмів
- •Класифікація живильних середовищ
- •Біохімічна ідентифікація бактерій за допомогою тест-систем
- •Методи знезаражування біологічних об'єктів.
- •Принципи і методи виділення чистих культур бактерій
- •Бактеріологічне дослідження
- •Посів петлею
- •Посів шпателем
- •Метод розведень
- •Метод поверхневих штрихів. Методи виділення чистих культур, засновані на механічному принципі
- •Колонії за методом Дригальського
- •Колонії за методом Дригальського
- •Метод штрихів
- •Методи виділення чистих культур, засновані на біологічному принципі
- •Етапи видiлення чистих культур мiкроорганiзмiв
- •Виділення чистої культури анаеробних бактерій
- •Виділення та ідентифікація анаеробних мікроорганізмів
- •Середовища для культивування анаеробних мікроорганізмів
- •Ідентифікація мікроорганізмів за допомогою бактеріофагів
- •Фаготипування бактерій
- •Визначення бактеріоциногенності мікроорганізмів
- •Бактеріоцинотипування (зони затримки росту)
- •Молекулярно-генетичні методи
- •Реакція гібридизації
- •Підсумок: Основні види ідентифiкацiї чистих культур
- •Характеристика колоній
- •Мікрофлора грунту
- •Основні представники мікрофлори грунту:
- •Мікрофлора води
- •Мікробіологічні показники безпеки питної води
- •Мікрофлора повітря
- •Мікробіоценоз, біотоп, екологічна ніша.
- •Мікрофлора людини
- •Основні представники мікрофлори різних відділів тіла людини.
- •Значення нормальної мікрофлори людини
- •Методи вивчення мікрофлори людини.
- •Значення мікрофлори людини.
- •Дисбактеріози і способи їх попередження.
Методи знезаражування біологічних об'єктів.
Головний напрям у боротьбі з інфекційними хворобами – профілактичний. У зв’язку з цим у діяльності лікувальних закладів велике значення має попередження попадання збудників захворювань в організм людини або інші об’єкти. Це проводиться добре розробленими й апробованими методами мікробної деконтамінації. Основні з них – стерилізація, дезінфекція, антисептика та асептика.
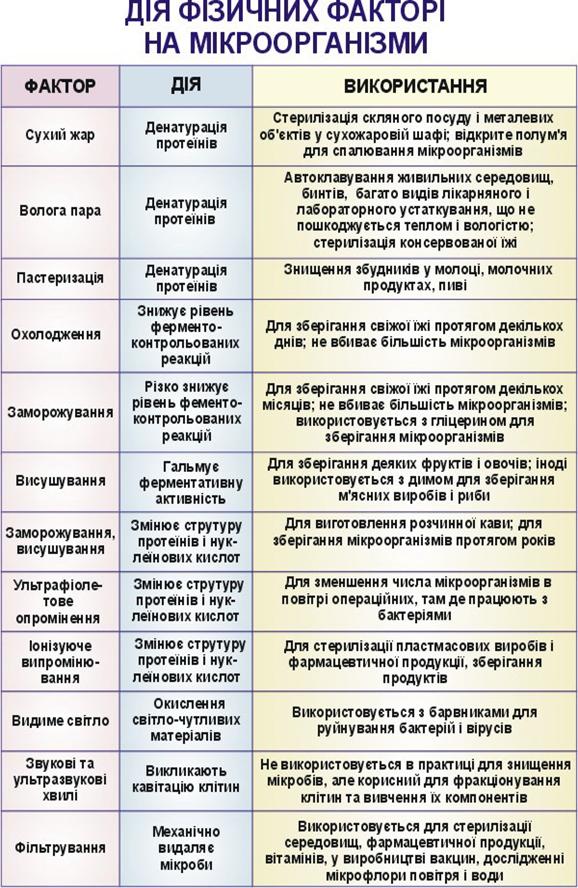
Стерилізація (від лат. sterilis – безплідний, вільний від бактерій) – повне знищення вегетативних і спорових форм усіх мікроорганізмів на предметах, матеріалах, у живильних середовищах.
У медичній практиці стерилізують інструменти, перев’язочний і шовний матеріал, операційну білизну, лікарські препарати. У мікробіологічних лабораторіях – живильні середовища, пробірки, піпетки, колби, чашки Петрі тощо. Тому перед стерилізацією необхідно вміти підготувати інструменти, посуд, пробірки, піпетки, перев’язочний матеріал та інше.
Інструменти обробляють у такій послідовності. Спочатку їх прополіскують у проточній воді, потім замочують у миючому розчині 15 хв, миють у тому ж розчині 0,5-1 хв, прополіскують проточною і дистильованою водою, висушують у сухожаровій шафі при 80-85 °С до повного зникнення вологи.
Пробірки, флакони, колби закривають ватними пробками. Пробірки загортають у папір по 25-30 штук, а чашки Петрі – по 4-5 штук або вміщують у стерилізаційні коробки (бікси). Пастерівські й градуйовані піпетки з широкого кінця затикають ватою, обгортають папером або вміщують у картонні чи металеві пенали по 10-15 штук. Живильні середовища в колбах, флаконах, пробірках також закривають пробками.
У лабораторній практиці використовують такі види стерилізації: а) високою температурою; б) механічна (холодна); в) хімічними речовинами і газами.
Існує багато способів стерилізації з допомогою високої температури. Ефективність такої стерилізації при нагріванні характеризується показником D – часом, який необхідний при даній температурі, щоб отримати десятикратне зменшення популяції бактерій (на 90 %). Його величина вимірюється, як правило, у хвилинах.
Прожарювання в полум’ї пальника – швидкий й абсолютно надійний спосіб. Ним стерилізують бактерійні петлі, пінцети, предметні й покривні скельця.
Кип’ятіння протягом 40 хв у спеціальних стерилізаторах використовують для обробки хірургічних інструментів, шприців, голок, гумових трубок. Для підвищення температури кипіння й усунення жорсткості води додають 1 % бікарбонатунатрію. Цей метод не забезпечує повної стерилізації, оскільки спори деяких видів бацил і клостридій витримують кип’ятіння протягом декількох годин.
Стерилізацію сухим жаром у сухожаровій шафі проводять при 160 °С протягом 120-150 хв, або при 180 °С – 45-60 хв після досягнення заданої температури.
Стерилізують переважно скляний посуд. Перевага цього методу над іншими полягає в тому, що не пошкоджується скло, не відбувається корозії металевих інструментів. Його можна використати для стерилізації термостійких порошків та інших речовин. Одним з недоліків даного методу є достатньо тривалий строк стерилізації. Крім того, при високих температурах може відбутися обвуглювання і загоряння ватних пробок, паперу, в який загорнутий посуд.
Стерилізація парою під тиском – найнадійніший метод повного знищення бактерій та їх спор. Він досягається дією пари, температура якої під тиском вища, ніж при кип’ятінні. Таку стерилізацію проводять в автоклаві. Стерилізація парою під тиском більш ефективна, ніж дія сухого жару.
Існують різноманітні електричні автоклави, які відрізняються між собою за розмірами, формою, розташуванням (вертикальні та горизонтальні), вони можуть бути з ручним керуванням, напівавтоматичні й автоматичні.
Конструктивно всі типи автоклавів представляють собою двостінний міцний металевий котел циліндричної форми з кришкою, яка герметично закривається, що дозволяє витримати високий тиск.
Внутрішня частина автоклаву є стерилізаційною камерою, в яку вміщують матеріал, що стерилізується. Вона має спеціальний кран для виходу повітря і манометр із запобіжним клапаном. Манометр визначає робочий тиск пари в камері, а запобіжний клапан сприяє виходу надлишку пари з метою запобігання розриву автоклава. Дистильовану воду в водопарову камеру заливають через спеціальну лійку, стежачи за її рівнем у спеціальній водомірній трубці. Пара із водопарової камери поступає в стерилізаційну камеру через спеціальні отвори в її верхній частині. Сучасні автоклави мають манометри і автоматичні регулятори включення і відключення струму, тримаючи заданий тиск, а отже й задану температуру всередині автоклава. Робота з ним вимагає суворого дотримання правил безпеки, які викладені в інструкції до кожного автоклава.
Основні правила роботи з автоклавом
1. Перед початком роботи слід ретельно оглянути автоклав, його контрольно-вимірювальну апаратуру, перевірити пружність резинової прокладки, кріплення кришки стерилізаційної камери.
2. Через спеціальну лійку до рівня відмітки на водомірній трубці в автоклав заливають дистильовану воду і закривають кран.
3. Необхідний матеріал вміщують у стерилізаційну камеру і закривають герметично кришкою автоклава. Бажано стежити, щоб предмети не розташовувалисьв автоклаві дуже тісно, оскільки між ним повинна проходити пара. В іншому випадку вони можуть залишитись нестерильними через відсутність нагріву до необхідної температури.
4. Відкривають кран, який з’єднує стерилізаційну камеру з оточуючим середовищем, і включають електричний нагрів.
5. Після того, як почався процес утворення пари, необхідно видалити повітря із стерилізаційної камери. Для цього пару і конденсат відводять успеціальну посудину з водою або в каналізацію. Чисту пару, яка виходить з автоклава з рівномірним шиплячим звуком, протягом 10 хв пропускають через камеру, а потім закривають паровідвідний кран.
6. Доводять тиск пари до рівня, якого вимагає режим стерилізації. Для цього враховують співвідношення показників тиску манометра і температури кипіння води (табл.).
7. По завершенні циклу стерилізації автоклав відключають. Тиск в автоклаві поступово падає і зрівнюється з атмосферним. Тоді відкривають випускний кран і поступово випускають надлишок пари у посудину з водою. Недотримання цих правил може призвести до різкого зниження тиску, внаслідок чого рідина в пробірках, колбах, які стерилізувались, бурхливо закипає, змочуючи ватно-марлеві пробки і навіть виштовхуючи їх. Така ситуація порушує стерильність матеріалу.
В автоклаві при 120 °С протягом 20 хв стерилізують прості живильні середовища (МПБ, МПА), ізотонічні розчини, білизну, перев’язочний матеріал, а при 134 °С – знешкоджують заразні матеріали, відпрацьовані культури бактерій протягом 40 хв. Середовища з вуглеводами не витримують такої обробки, оскільки вони карамелізуються, у зв’язку з чим їх стерилізують текучою парою.
Стерилізація текучою парою (100 °С) проводиться в автоклаві з незагвинченою кришкою. При нагріванні пара проникає між вкладеними об’єктами й стерилізує їх. Таким способом обробляють середовища з вуглеводами. Оскільки одноразова дія пари не вбиває спори, застосовують дробну стерилізацію – 3 дні підряд по 30 хв. Ті спори, які не загинули при першому нагріванні, проростають до наступного дня у вегетативні клітини й гинуть придругій і третій обробці.
Для тих речовин, які не витримують 100 °С (білкові рідини, вітаміни, деякі ліки), застосовують тиндалізацію – стерилізацію на водяній бані при температурі 58-60 °С протягом години 5-6 днів підряд. Однак цей метод зараз широко не застосовується, оскільки вимагає значних затрат часу на його проведення.
Пастеризацією вважають одноразове прогрівання матеріалу до температури нижче 100 °С, при якій знищуються, в першу чергу, вегетативні форми мікроорганізмів. Цей спосіб вперше запропонував Л. Пастер для знищення безспорових форм мікробів, переважно патогенних і умовно-патогенних видів. Спори при цьому залишаються живими, а мікроорганізми, що залишились, стають помітно ослабленими. Метод широко використовують у харчовій промисловості, коли при кип’ятінні можуть втратитись органолептичні властивості продуктів. Так проводять термічну обробку молока, пива, вина, різних соків при 70 °С протягом 30 хв або при 80 °С – 5-10 хв. Пастеризовані продукти зберігаються на холоді.
Згортання (ущільнення) сироватки і яєчних середовищ з одночасною їх стерилізацією проводять у спеціальних згортувачах Коха з електричним підігрівом.
Асептично приготовлені сироватки та яєчні середовища у нахиленому положенні прогрівають однократно при 80-90 °С одну годину. При підозрі на мікробну контамінацію їх прогрівають при тій же температурі три дні підряд.
Механічні методи стерилізації широко використовуються в мікробіологічних лабораторіях. Особливо за тих умов, коли підвищена температура може зруйнувати субстрати. Це стосується рідких середовищ і рідин, які містять білки, вітаміни, антибіотики, вуглеводи, леткі речовини тощо. Метод можна застосувати для очищення бактеріальних токсинів, бактеріофагів від мікроорганізмів. Однак цей метод вважається менш надійним порівняно із класичною стерилізацією.
Механічна (холодна) стерилізація проводиться за допомогою фільтрування через дрібнопористі антибактеріальні чи антивірусні фільтри. Їх створюють із спеціальних матеріалів, пронизаних порами, які мають різну форму та йдуть через фільтр звивисто. Фільтри можна виготовляти із позитивно зарядженого матеріалу, тоді бактерії, що несуть на поверхні негативний заряд ще й взаємодіють з ним електростатично, а не тільки механічно внаслідокрізного діаметру бактерій і пор. Щоб попередньо перевірити якість фільтрів, використовують дрібні тест-мікроорганізми (Serratia marcescens абоPseudomоnas aeruginosa). Фільтрат висівають на живильне середовище і витримують при оптимальній температурі протягом 5 днів. При відсутності росту тест-бактерій можна застосовувати фільтр для стерилізації.
Промисловість різних країн випускає найрізноманітніші фільтри, які різняться за матеріалом виготовлення й діаметром пор. Мембранні або колоїдні фільтри, які виготовляють із нітроцелюлози, представляють собою диски діаметром до 35 мм.
У мікробіологічних лабораторіях часто використовують фільтри Зейтца. Вони представляють собою пластини (диски або квадрати) товщиною 4-6 мм, які виготовляють із суміші азбесту і целюлози.
Однак ці фільтри мають ряд недоліків, які слід враховувати при роботі з ними. По-перше, можливе забруднення фільтратів сторонніми речовинами, які попадають у нього з фільтра (луги, солі лужних металів, волокна азбесту). По-друге, азбест внаслідок свого негативного заряду зв’язує деякі речовини зрідини, що фільтрується. Крім того, слід ретельно перевіряти фільтри перед роботою, щоб не використовувати ті, які мають механічну деформацію (тріщини, надломи тощо).
Крім азбестових, широко використовуються фарфорові фільтри, вперше запропоновані Пастером і Шамберланом. Їх інакше називають свічки Шамберлана. Виготовляють їх із каоліну й кварцового піску та надають форми порожнистогоциліндра, який закритий з одного кінця. Величина пор позначається L1-L13. Фільтри L5-L13 є антибактеріальними.
Інший тип фільтрів, які виготовляють з інфузорної землі (діатоміту або кізельгуру), одержав назву свічок Беркефельда. За своїм зовнішнім виглядом вони подібні до циліндрів, замкнутих з одного з кінців. Свічки маркують літерами V, N i W, що відповідає діаметру пор в межах відповідно 8-12, 5-7 і 3-4 мкм.
Випускаються ще й стерилізуючі фільтри із скла „Пірекс” у вигляді двошарових дисків. Поділяють фільтри за розміром пор на три основних типи: С, М і Р. Розмір пор у них відповідно становить понад 1,7, від 1 до 1,7 і менше 1 мкм.
Перед роботою фільтр закріпляють у спеціальному тримачі. Зокрема, азбестові пластинки вміщують між циліндричною й опорною частиною металевого корпусу апарата Зейтца. Обидві частини з’єднують гвинтами. Зібраний фільтр вставляють у гумовий корок колби Бунзена з боковим відростком. Повністю вмонтований фільтр загортають у папір і стерилізують в автоклаві. Рідину для фільтрування наливають у металевий циліндр, з’єднують боковий відросток колби з вакуумним насосом, щоб створити вакуум у колбі й прискорити фільтрування. Фільтрат у колбі буде стерильним.
Хімічним способом стерилізують вироби з гумових і полімерних матеріалів. Для цього використовують 6 % розчин перекису водню, в який занурюють вироби на 6 год при 18 °С і на 3 год при 50 °С. Можна застосувати розчин дексона з експозицією 45 хв при 18 °С. Після закінчення стерилізації вироби двічі прополіскують у стерильній дистильованій воді, кожного разу змінюючи її, та переносять корнцангом у стерильний бікс.
Інструменти для ендоскопії й автоматичні піпетки можна також стерилізувати спиртом.
Газовий метод стерилізації парами формальдегіду, хлороформу, -пропіолактону, окисом етилену, окисом пропілену, метилброміду, озоном використовують для знезараження ендоскопічних інструментів, апаратів для штучного кровообігу, радіоелектронного обладнання, пластмасових виробів, кетгуту тощо. Ефективною зарекомендувала себе суміш окису етилену і бромистого метилу в співвідношенні 1:1,44. Для проведення стерилізації газом використовують спеціальні щільні камери, які герметично закриваються. Для кожного діючого фактора розроблено свої режими стерилізації. Після завершення процедури газова суміш викачується з камери і замінюється стерильним повітрям. Предметами, які булопростерилізовано вказаним способом, рекомендується користуватись не раніше, ніж через 24 год, для того, щоб видалився весь газ.
Одним із методів стерилізації є застосування різних типів опромінення. У практиці використовуються для цього електрони, гамма-промені, ультрафіолетові промені, радіочастотне опромінення.
Електронні прискорювачі дозволяють фокусувати електрони у вузький спрямований пучок високої потужності. Цей метод використовують для стерилізації в промислових масштабах хірургічного перев’язочного і шовного матеріалів ще на етапі їх виробництва. Недоліком даного методу стерилізації є низька проникність променів.
До гамма-опромінення чутливі вегетативні та спорові форми різноманітних бактерій, грибів, дріжджів, віруси. Опромінення потужністю 2,5 Мрад використовується для знезараження антибіотиків, вітамінів, стероїдних та інших гормонів, пластмасового одноразового устаткування (чашок Петрі, шприців), хірургічного перев’язочного та шовного матеріалів тощо.
Стерилізацію за допомогою ультрафіолетового опромінення проводять для знешкодження бактерій в повітрі операційних, палат, боксів, мікробіологічних лабораторій тощо. Для цього використовують спеціальні бактерицидні лампи різної потужності – БУВ-15, БУВ-30 та ін.
Однак слід пам’ятати, що мікроби можуть бути захищені від дії ультрафіолетового опромінення численними органічними речовинами, пилом та іншими факторами. Вегетативні форми бактерій у 3-10 разів більш чутливі до УФО, ніж спори.
Методи радіочастотного опромінення на сьогодні починають інтенсивно розроблятись, особливо у харчовій промисловості. Складність їх полягає в небезпеці для обслуговуючого персоналу (наприклад, перешкоди систем зв’язку, різна частота опромінення, яка застосовується для знешкодження мікроорганізмів).
Для перевірки ефективності стерилізації, надійності роботи автоклавів застосовують хімічний та біологічний контроль. Відомі хімічні речовини з певною температурою плавлення: бензонафтол – 110 °С, антипірин – 115 °С, сірка – 119 °С, бензойна кислота – 120-122 °С, манноза і сечовина – 132-133 °С. Саме при таких температурах найчастіше здійснюють стерилізацію. Хімічні речовини вміщують у скляні трубки, додають невелику кількість анілінового барвника (сафранін, фуксин або метиленовий синій), запаюють і кладуть між об’єктами, що стерилізуються. Рівномірне забарвлення препарату в колір барвника в трубці свідчить про належну температуру в автоклаві, а отже й надійність стерилізації. Для біологічного контролю стерилізації в автоклав вміщують спеціальні біотести – смужки фільтрувального паперу, марлі тощо, на яких знаходяться спори бактерій з відомою термостійкістю, спори відомої чисельності та ін.
Вони розкладаються в біксах, які підлягають стерилізації. Після завершення циклу в пробірки з смужками заливають живильне середовище та інкубують при оптимальній температурі. Відсутність проростання спор бактерій свідчить про ефективну стерилізацію.
У таблиці наведено основні способи стерилізації різних медичних об’єктів.
Способи стерилізації медичних об’єктів

Дезінфекція. Дезінфекція – це сукупність заходів для повного, часткового або селективного знищення потенційно патогенних для людини збудників на різних об’єктах довкілля з метою попередження передачі збудника від джерела інфекції до сприйнятливого організму.
Оскільки мікроорганізми мають різну чутливість до дезінфікуючих засобів, виділяють чотири ступені дезінфекції: A, B, C, D. Дезінфекційні заходи ступеня A передбачають знищення аспорогенних форм мікробів, рикетсій, мікоплазм, найпростіших. Заходи ступеня B використовуються для ліквідації грибів, деяких вірусів, бактерій, що мають підвищену стійкість (стафілококи, мікобактерії). Боротьба із збудниками особливо небезпечних інфекцій (чуми, холери, висипного тифу, меліоїдозу, сапу) вимагає заходів ступеня С. Знищення спор мікроорганізмів і найпростіших – заходів ступеня D.
Заходи дезінфекції, що використовуються в клініках, мікробіологічних, вірусологічних та інших лабораторіях досить різноманітні. Їх умовно можна поділити на 2 групи: фізичні та хімічні.
До першої групи можна віднести спалювання використаного перев’язочного матеріалу, відходів, сміття, пропалювання в полум’ї пальника, дію сухого жару, автоклавування за різних режимів, використання ультразвуку. Ефективними заходами є кип’ятіння предметів особливо з поверхнево активними речовинами, дезінфекція повітря за допомогою ультрафіолетового опромінення. Постійно використовуються такі елементарні заходи, як вологе прибирання, миття, очищення, витріпування ковдр, простирадл тощо. Такі заходи хоча й не знищують мікроорганізмів, однак сприяють суттєвому зниженню їх популяцій на різних об’єктах.
Потужним комплексом дезінфекційних заходів виступають численні хімічні препарати – дезінфектанти. До них пред’являють певні вимоги: 1) протимікробний ефект широкого спектра дії; 2) висока розчинність у воді, здатність утворювати з водою або повітрям активні та стійкі суспензії, емульсії, аерозолі; 3) здатність не втрачати протимікробних властивостей при наявності в середовищі органічних домішок; 4) низька токсичність; 5) відсутність алергізуючої дії; 6) відсутність пошкоджуючого ефекту щодо предметів, які ними обробляються; 7) доступність сировини, з якої виготовляються дезінфектанти, її дешевизна тощо.
Існує декілька сотень дезінфікуючих засобів різних груп. Серед них алкоголі, альдегіди, четвертинно-амонієві сполуки. Найширше використання знайшли хлоромісткі препарати. До них належать 0,2-1,0 % хлорне вапно, яке виготовляють ex tempore з 10 % освітлених розчинів цієї речовини; 0,2-1,0 % розчини хлораміну В або Т; 5 % водні розчини гіпохлориду кальцію; 0,05-0,1 % розчин трихлоізоцианурової кислоти (диконіту); 0,1-0,2 % розчин сульфохлорантину. Окислювачі представлені 1-10 % розчином перекису водню, фенолами та їх похідними – 3-5 % розчинами лізолу, карболової кислоти, фенолу. До групи препаратів із солей важких металів належать мертиолят натрію, сулема. Широке застосування набули 2-3 % розчин формальдегіду, 3-10 % розчин крезолу та інші. Використовуються в практиці й газоподібні дезінфектанти – 40 % водний розчин формальдегіду, суміші окису етилену з вуглекислим газом (1:10) і окису етилену з бромідметилом (1:1).
На практиці виділяють поточну та заключну дезінфекцію. Поточну дезінфекцію проводять для зменшення мікробної контамінації у вогнищах інфекції. Їй підлягають ліжка, постільна і натільна білизна, рушники, матраци, подушки, меблі, килими, посуд, інструменти, прилади, що знаходяться на поверхні різних об’єктів, повітря, виділення, стічні води тощо.
Зокрема, поверхні столів, вікон, стелі, стіни, меблі дезінфікують протиранням і миттям з допомогою дезінфікуючих розчинів, постільну та іншу білизну перуть у цих розчинах. Ліжка, матраци, подушки обробляють у спеціальних камерах термохімічними методами, м’які меблі – за допомогою спеціальних аерозолів, посуд – зануренням у дезінфікуючі розчини. Обробка виділень і стічних вод проводиться термічними і хімічними методами. Повітря приміщень можна дезінфікувати пропусканням через спеціальні антибактеріальні фільтри, як це роблять в палатах гнотобіологічної ізоляції, або опромінюючи його ультрафіолетовими променями. Медичні інструменти, прилади спочатку очищають, дезінфікують, а потім, у разі потреби, стерилізують відомими способами.
Заключна дезінфекція проводиться з метою знищення збудників інфекційних захворювань у приміщенні, де перебував інфекційний хворий, і предметах, зякими він був у контакті. Така ситуація складається після виписування його з інфекційного стаціонару, переводу із соматичного відділення в інфекційне тощо.
Для забезпечення догляду за проведенням дезінфікуючих заходів розроблену спеціальну систему контрою. Вона включає в себе: а) зовнішній і внутрішній контроль відділами дезінфекції санітарно-епідеміологічних станцій та лабораторій лікувально-профілактичних закладів, який здійснюється візуальним, бактеріологічним, біологічним, хімічним та іншими методами; б) бактеріологічний контроль проводять, виявляючи у вогнищах інфекції індикаторних бактерій: при кишкових захворюваннях – кишкові палички, при крапельних інфекціях, туберкульозі – стафілококи, у лікувально-профілактичних закладах – умовно-патогенні мікроорганізми; контроль здійснюється 1 раз у місяць – один раз у квартал залежно від рангу лабораторії; в) забір контрольних проб (10-30 штук) проводять не раніше, ніж через 30-45 хвилин після закінчення дезінфекції; площа змивів не повинна бути меншою, ніж 200 см2; г) змиви беруть стерильними ватними тампонами і засівають на живильні середовища з дотриманням всіх правил асептики з метою запобігання контамінації сторонньою флорою; для виділення бактерій групи кишкової палички і золотистих стафілококів користуються спеціальними наборами живильних середовищ і схемами ідентифікації, визначених відповідними інструкціями.
Дезінфікуючі заходи вважаються ефективними, якщо у пробах не визначаються бактерії групи кишкової палички, умовно-патогенні мікроби, золотисті стафілококи.
Велике значення у практичній медицині має антисептика (комплекс лікувально-профілактичних заходів, спрямованих на знищення мікроорганізмів у рані або в організмі в цілому). Ще у 1865 р. М. І. Пирогов підкреслював необхідність знищення джерела госпітальної інфекції і застосовував для боротьби з нагниванням ран хлорну воду, нітрат срібла, йод та інші антисептичні речовини. У 1867 р, Д. Лістер як антисептичний засіб широко застосовував фенол.
Учення про антисептику відіграло позитивну роль у розвитку хірургії. Практичне застосування мікробіології в хірургії привело до зменшення кількості післяопераційних ускладнень, гангренозних процесів і значною мірою зумовило зниження смертності в хірургічних відділеннях.
У 1897 p. E. Бергман запровадив у практику хірургії асептику — систему заходів, спрямованих на запобігання потраплянню в рану мікроорганізмів.Для цього використовують стерилізацію хірургічного інструментарію і шовного матеріалу, обробку рук хірурга перед операцією, поверхні шкіри в ділянці операційного поля, а також дезинфекцію повітря і предметів операційної.
Запам’ятайте:
Стерилізація – повне знищення вегетативних і спорових форм усіх мікроорганізмів на певних предметах, матеріалах, живильних середовищах.
Дезинфекція – сукупність фізичних, хімічних і механічних способів знищення вегетативних і спорових форм патогенних і умовно-патогенних мікроорганізмів.
Антисептика – комплекс лікувально-профілактичних заходів, спрямованих на знищення або пригнічення росту мікробів у рані, на поверхні шкіри чи слизових оболонок.
Асептика – система профілактичних заходів, спрямованих проти проникнення мікробів у рану, тканини, органи хворого.
Лабораторна робота № 7
