
- •Термодинамика состояния рабочих сред тепло- и массообменных аппаратов кондиционирования.
- •Джозия Уиллард Гиббс
- •Термодинамика влажного воздуха, все характеристики его состояния.
- •Процессы нагрева и охлаждения.
- •Процессы адиабатного (изоэнтальпийного) увлажнения
- •Изотермический процесс увлажнения
- •Политропические процессы тепло- и влагообмена
- •Процессы смешения
- •Процессы тепло- и влагообмена между воздухом и водой.
- •Список литературы:
Процессы смешения
При кондиционировании
в ряде случаев наружный воздух, подаваемый
в помещение, смешивают с внутренним
воздухом (рециркуляция внутреннего
воздуха). Возможны и другие случаи,
связанные с перемешиванием масс воздуха
разного состояния. Процесс смешения
воздуха при построении на I — d-диаграмме
изображается прямой, соединяющей точки
состояния воздуха смешиваемых масс.
Точка смеси всегда располагается на
этой прямой и делит ее на отрезки, обратно
пропорциональные смешиваемым количествам
воздуха. Если смешать воздух состояния
1 (рис. 4) в количестве
G
с воздухом
состояния 2
в количестве
nG,
то точка смеси
3 разделит отрезок 1—2 или его проекции
 на
части 1—3, 3—2 или
на
части 1—3, 3—2 или

 (26)
(26)
Таким образом, чтобы найти точку смеси, нужно прямую 1 —2 или ее проекции разделить на n+1 частей и отложить от точки 1 одну часть, оставив п частей до точки 2. Такое построение определит положение точки смеси. Возможен случай, когда точка смеси 3' окажется в области ниже линии ф= 100%. Это значит, что при смешивании будет образовываться туман (конденсация, образование капель из водяного пара, содержащегося в воздухе). Если принять температуру выпадающей влаги, близкой к температуре мокрого термометра, соответствующей (Iз- = const) точке смеси 3' (рис. 5), то действительные параметры точки смеси 3 будут соответствовать пересечению линий Iз' = const и Ф= 100%.
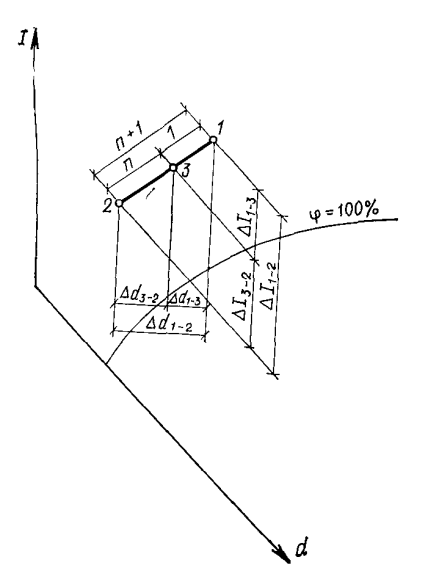
Рис. 4

Рис. 5
Процессы тепло- и влагообмена между воздухом и водой.
В кондиционировании воздуха широко используются аппараты, в которых воздух взаимодействует с пленкой или распыленными каплями воды, имеющими различную температуру.
Обычно предполагают, что непосредственно над поверхностью капель или пленки воды находится тонкий слой воздуха, полностью насыщенный водяным паром и имеющий температуру, равную температуре воды.
В этом случае процесс тепло- и массообмена между влажным воздухом и водой можно рассматривать как процесс смешения основного потока воздуха с насыщенным воздухом над поверхностью воды.
Используя указанное предположение, А.А. Гоголин [6] сформулировал правило, называемое законом прямой линии: при взаимодействии влажного воздуха с водой, имеющей постоянную температуру, изменение его состояния изображается на J-d диаграмме прямой, проходящей через точку начального состояния воздуха и точку на линии насыщения ( = 100%) с температурой, равной температуре воды.
При большой поверхности и длительном времени контакта процесс продолжается до тех пор, пока воздух не станет насыщенным и не примет температуру воды.
Вся область возможных изменений параметров воздуха начального состояния, заданного на J-d диаграмме точкой А, ограничивается прямыми АВ и АС, проведенными из точки А касательно к кривой насыщения (рис. 6). При этом в зависимости от температуры воды можно выделить следующие зоны.
Зона 1. Температура воды ниже температуры точки росы обрабатываемого воздуха. В результате взаимодействия влажного воздуха с водой такой температуры уменьшаются: энтальпия, температура и влагосодержание воздуха, т.е. происходят процессы охлаждения и осушения воздуха.
Зона 2. Температура воды равна температуре точки росы. В этом процессе уменьшаются энтальпия и температура воздуха при постоянном влагосодержании.
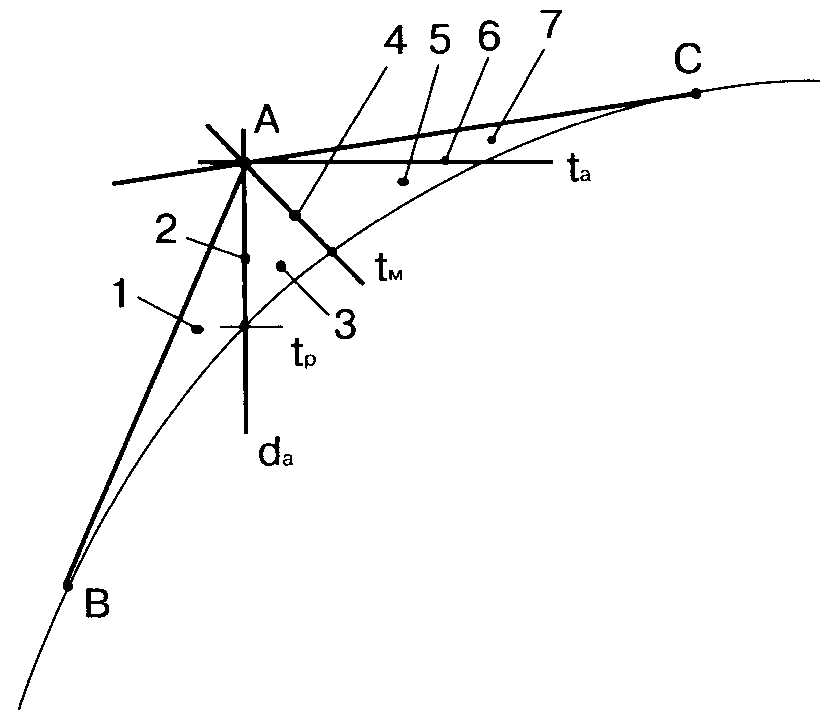
Рис. 6. Возможные процессы взаимодействия влажного воздуха и воды:
1...7 - зоны процессов
Зона 3. Температура воды выше температуры точки росы воздуха, но ниже его температуры по мокрому термометру. При обработке воздуха увеличивается его влагосодержание, но уменьшаются энтальпия и температура, следовательно, воздух увлажняется и охлаждается.
Зона 4. Температура воды равна температуре воздуха по мокрому термометру. Такой процесс называют адиабатным увлажнением воздуха циркулирующей водой. Это единственный реальный процесс, при котором температура воды остается постоянной.
Зона 5. Температура воды выше температуры воздуха по мокрому термометру, но ниже его температуры по сухому термометру. При контакте с такой водой влагосодержание и энтальпия воздуха возрастают, а его температура по сухому термометру снижается. Однако, поскольку процесс увлажнения сопровождается ростом энтальпии, такой процесс следует считать процессом увлажнения и нагревания.
Зона 6. Температура воды равна температуре воздуха по сухому термометру. В этом случае происходит рост влагосодержания и энтальпии воздуха, а его температура по сухому термометру остается постоянной.
Зона 7. Температура воды выше температуры воздуха по сухому термометру. Процесс протекает так же, как в зоне 6, но одновременно происходит повышение температуры воздуха.
В реальных аппаратах расход воды и поверхность контакта имеют конечные значения, и температура воды в процессе тепло- и массообмена не может быть постоянной (кроме режима адиабатного увлажнения).
Поэтому фактические процессы изменения состояния влажного воздуха при его обработке водой изображаются кривыми линиями, направленными из точки начального состояния воздуха к точке на кривой насыщения, соответствующей конечной температуре воды. Причем относительная влажность воздуха, выходящего из контактного аппарата, практически равна 85...95%.
Дополнительно рассмотрим термодинамику состояния других рабочих сред, которые используются в УКВ, а именно водных и других растворов.
Растворы солей используют в качестве рабочего тела в теплообменниках при температурах ниже 0°С; растворы хладонов— для повышения термодинамического совершенства циклов компрессорных тепловых насосов; водоаммиачные, бромистолитиевые и хлористолитиевые растворы — в абсорбционных холодильных машинах и в тепловых насосах.
Над поверхностью жидких растворов находятся насыщенные пары компонентов. Если растворенное вещество является нелетучим, например растворы солей, то насыщенный пар состоит только из молекул растворителя; если оба компонента летучи, то насыщенный пар включает молекулы обоих компонентов.
Для расчета параметров состояния растворов необходимо иметь зависимости, связывающие концентрации компонентов в жидкой фазе Кр1 и Kр2 с концентрациями Kp1 п и Кр2 п и парциальными давлениями компонентов (р1 , p2) в паровой фазе.
По аналогии с теорией газов в теории растворов вводится понятие идеального раствора. В природе отсутствует идеальный раствор, так же как и идеальный газ. Наиболее близко требованиям идеальных отвечают растворы, в которых компоненты имеют близкие физико-химические свойства. При образовании таких растворов не происходит электролитической диссоциации. Среди растворов, используемых в СКВ, близкими к идеальным являются водные растворы хладонов. Для идеальных растворов существует простая связь между мольной концентрацией компонента в растворе Kp1 и парциальным давлением его насыщенных паров над раствором p1.
 (27)
(27)
где p1,0— давление насыщенного пара данного компонента в свободном состоянии.
Эта зависимость носит название закона Рауля.
РАУЛЬ (Raoult), Франсуа Мари
(10 мая 1830 г. – 1 апреля 1901 г.)
Французский химик Франсуа Мари Рауль родился в Фурн-ан-Веп, Нормандия. Первоначальное образование получил в Лионской коллегии; учился в Парижском университете. С 1853 г. был учителем в Реймском лицее, затем в колледже в Сен-Дье, а с 1865 г. в лицее в Сансе; в 1867-1901 гг. работал в Гренобльском университете, где был профессором химии (с 1870), а затем и деканом факультета.
Научная деятельность Рауля началась в 1863 г.; его первые исследования относились к переходу химической энергии в энергию электрического тока. В своих исследованиях Рауль пытался объяснить различие между количеством теплоты, выделенным в гальваническом элементе и вычисленным по закону Джоуля-Ленца, различными вторичными процессами. Главной заслугой Рауля стали выполненные им исследования понижения температуры замерзания и понижения упругости пара (или, что то же самое, повышения температуры кипения) растворителя при введении в него растворенного вещества. Первая часть этих исследований была опубликована в 1882 г., и принадлежит к одним из первых блестящих исследований в области физической химии растворов. Рауль провёл многочисленные измерения температур замерзания и кипения водных и неводных растворов различных веществ и пришёл в выводу: количества различных веществ, которые вызывают одинаковое (по сравнению с чистым растворителем) понижение температуры замерзания или повышение температуры кипения, зависят только от их молекулярных масс. Законы Рауля дали возможность определять молекулярные массы по понижению температуры замерзания или по повышению температуры кипения разбавленных растворов. Рауль ввёл в химию термин "криоскопия"; сконструировал газовую горелку для газового анализа (1876), усовершенствованную позже Р. В. Бунзеном. Открыл закон понижения сжимаемости растворов с увеличением их концентрации, обнаружил тиофен в техническом бензоле.
Из этого закона, в частности, вытекает, что с повышением концентрации растворенного вещества в воде (т. е с уменьшением концентрации Кр1 воды) парциальное давление водяных паров над поверхностью раствора уменьшается. В этом случае, если водный раствор используется в качестве рабочего тела, вступающего в непосредственный контакт с воздухом, над его поверхностью образуется слой влажного воздуха, равновесного относительно данного раствора. Параметры воздуха над раствором будут отличаться от параметров насыщенного воздуха над водой. Парциальное давление водяного пара в воздухе над раствором, а также его влагосодержание и энтальпия определяются температурой раствора и температурой его замерзания.
Особенность их использования состоит лишь в том, что относительная влажность 1 = const над раствором будет отличаться от 0 = const над водой при прочих равных условиях. Приближенно эта зависимость, так же как и для случая разных барометрических давлений , будет пропорциональна соответствующим давлениям пара, а именно:
1/Р1 = о/P1, 0 (28)
где р1 р1,0—давление пара непосредственно над поверхностью раствора и воды.
К наиболее существенным недостаткам водных растворов солей следует отнести значительную коррозионную активность. Особенно высокой коррозионной активностью по отношению к сталям и сплавам на основе железа обладают растворы бромистого лития. Поэтому в качестве конструктивных материалов при использовании бромистолитиевых растворов применяют латунь и медь. Меньшей коррозионной активностью обладают растворы хлористого лития, а также хлористого кальция и натрия. Коррозионную активность этих растворов можно свести к минимуму путем поддержания значения коэффициента электролитической диссоциации pH = 7 - 8,5. Для поддержания рН раствора на допустимом уровне следует добавлять ингибиторные добавки. Коррозионную активность хлористолитиевого раствора можно уменьшить применяя в качестве ингибиторов хромовые соли Na2CrO4 или К2Сr2О7, добавляемые в количестве 1—2% массы раствора. Для распространенного в системах кондиционирования с промежуточным теплоносителем раствора хлористого кальция в качестве ингибиторных добавок используют хромовую соль Na2Cr207-2H20.
При температурах рабочих тел выше 20°С может применяться раствор нитрита натрия. Растворы натрита натрия являются (при концентрации 28%) коррозионно инертными по отношению к сталям и сплавам на основе железа. Нитрит натрия пожаро- и взрывобезопасен, но обладает некоторой ядовитостью, что требует определенной осторожности при обращении с ним.
