
- •8.1 Методы оксидиметрии и их классификация
- •8.1.1 Теоретические основы перманганатометрии
- •Стандартизация титрантов в перманганатометрии
- •8.1.2 Метод иодометрии
- •8.2 Комплексонометрическое титрование, его виды
- •8.2.1 Комплексоны и их особенности
- •8.2.2 Индикаторы комплексонометрии
- •8.3 Применение методов оксидиметрии и комплексонометрии
8.2 Комплексонометрическое титрование, его виды
Комплексонометрическое титрование основано на реакциях образования комплексов. Среди реакций с участием неорганических лигандов в титриметрии применяют реакции образования галогенидов Hg(II), фторидов, Al, циркония, тория и цианидов некоторых металлов (Ni, Co, Zn). На образовании этих комплексов основаны методы меркуриметрии, фторидометрии и цианидометрии.
Известно много монодентантных неорганических и органических лигандов, однако их применению в комплексонометрии препятствует то, что ступенчатые константы устойчивости соответствующих комплексов мало различаются между собой. Поэтому при увеличении количества добавленного лиганда концентрация ионов Ме изменяется постепенно, и кривая титрования не имеет скачка.
Многие же полидентантные лиганды реагируют с ионами Ме в простом стехиометрическом соотношении (чаще всего 1:1). Титрование с использованием полидентантных органических реагентов называется комплексонометрией.
8.2.1 Комплексоны и их особенности
Широкое применение получили аналитические органические реагенты, предложенные в 1944 г. Г. Шварценбахом. Шварценбах отнес к ним группу аминополиуксусных кислот, содержащих иминодиацетатные фрагменты – N(CH2COOH)2, связанные с определенными алифатическими и ароматическими радикалами.
Сейчас известно большое число сходных соединений, в которых вместо алкилкарбоксильных групп введены другие кислотные группы – алкилфосфоновые, алкиларсоновые, алкилсульфоновые и др. Все они объединяются под общим названием – комплексоны.
Применяют следующие комплексоны:
1) комплексон I – нитрилотриуксусная кислота (H3Y), где Y‾3 – анион

2) комплексон II – этилендиаминтетрауксусная кислота (ЭДТУК) (H4Y)

3) комплексон III – динатриевая соль ЭДТУК – ЭДТА (Трилон Б) (Na2H2Y)
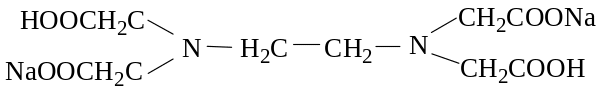
4) комплексон IV – диаминциклогексантетрауксусная кислота (H4Y)

В практике анализа наиболее часто применяют комплексон III (ЭДТА) в связи с наилучшей растворимостью его в воде.
С катионами Ме ЭДТА образует комплексные соединения в соотношении 1:1:
Ме2+ + [Y]4‾ ↔ [MeY]2‾
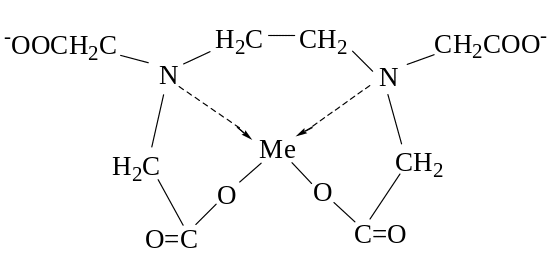
В комплексах ЭДТА часть связей носит ионный характер, часть донорно-акцепторный. Комплексы многих Ме с ЭДТА образуются легко, обладают достаточной устойчивостью и в большинстве растворимы в воде. Все это позволяет использовать ЭДТА для титриметрического определения солей Ме.
ЭДТУК (H4Y) – белое кристаллическое вещество мало растворимое в воде, так при 20оС растворимость ее всего лишь 28,3 мг в 100 мл. Растворимость H4Y минимальна при рН 1,6-1,8. При повышении и понижении концентрации ионов водорода растворимость растет. Высокая растворимость H4Y в минеральных кислотах объясняется образованием протонированных форм H5Y+ и H6Y2+.
ЭДТУК – четырехпротонная кислота, которая ионизирует по 4-м ступеням, причем по первым двум в значительной степени (рК1 = 2,07; рК2 = 2,75) по третьей и четвертой – гораздо меньше (рК3 = 6,24; рК4 = 10,34). Поэтому и ЭДТА в кислой среде (рН = 4,5) частично протонируется и находится в виде [H2Y]2‾, в слабо щелочной (рН = 8-9) под действием ОН‾ частично депротонируется и переходит в [HY]3‾, в сильно щелочной (рН > 12) полностью депротонируется и находится в виде Y4‾.
Реакция комплексообразования проходит между полностью ионизированной формой Y4‾ и ионами Ме и характеризуется общей константой образования (или устойчивости):
Y4‾
+ Ме2+
→ [MeY]2‾; ![]()
Чтобы реакция комплексообразования прошла с достаточной полнотой (на 99,99%) и могла быть использована в количественном анализе, константа образования должна быть > 108.
Устойчивость комплексов Ме с ЭДТА зависит от заряда иона Ме, электронной конфигурации и меняется в зависимости от рН среды. Наиболее устойчивые комплексы ЭДТА с многозарядными ионами р- и d-элементов могут образовываться в кислой среде. К ним относятся комплексы с Bi3+, Fe3+,Cr3+ и т.д. Менее устойчивые комплексы с ЭДТА образуют ионы s-элементов: Ba2+, Mg2+, Ca2+ и т.д. Их определение комплексонометрическим титрованием проводят в щелочной среде.
