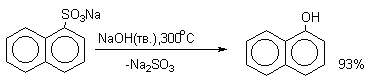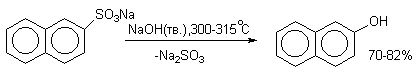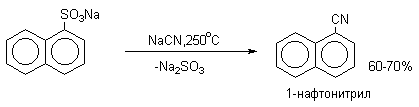- •Содержание
- •1. Электрофильные агенты
- •1.1. Сильные электрофилы
- •1.2. Электрофилы средней силы
- •1.3. Слабые электрофилы
- •2. Механизм электрофильного ароматического замещения
- •2.1. Электрофильный обмен водорода в ароматических соединениях
- •Бензол и метилбензолы
- •2.4. Обобщенный механизм электрофильного ароматического замещения
- •2.5. Стадия отщепления протона
- •2.6. Ориентация электрофильного замещения и реакционная способность замещенных бензолов
- •2.6.1. Изомерные -комплексы
- •2.6.2. Классификация заместителей
- •2.6.3. Ориентация как отражение свойств -комплекса
- •2.6.4. Факторы парциальных скоростей. Фактор селективности.
- •2.6.5. Ориентация замещения при наличии нескольких заместителей
- •2.6.6. Ориентация как отражение свойств исходного арена
- •2.7.1.Электрофильное замещение в полиядерных ароматических системах с изолированными бензольными ядрами
- •2.7.2.Электрофильное замещение в конденсированных бензоидных ароматических системах
- •3.Основные реакции электрофильного ароматического замещения
- •3.1.Нитрование
- •3.1.1. Природа электрофильного агента
- •3.1.2. Ипсо-нитрование
- •3.1.3. Методы синтеза ароматических нитросоединений
- •3.3. Алкилирование по Фриделю-Крафтсу
- •3.3.1. Кинетика и механизм
- •3.3.2. Реакция алкилирования ароматических углеводородов в органическом синтезе
- •3.4. Ацилирование по Фриделю-Крафтсу
- •3.5. Формилирование ароматических соединений
- •3.6. Сульфирование
- •3.6.1. Механизм сульфирования
- •3.6.2. Сульфирование бензола и его производных
- •3.6.3. Свойства аренсульфокислот
3.6.2. Сульфирование бензола и его производных
Бензол при действии 92-94%-ной серной кислоты при 40-50оС образует бензолсульфокислоту с выходом 90-96%. Введение одной сульфогруппы уменьшает скорость реакции введения второй сульфогруппы в 104 раз, поэтому мета-бензолсульфо-кислота получается при сульфировании бензола в жестких условиях избытком 20%-ного олеума при 100оС или 60%-ного олеума при 60-80оС. Длительное нагревание мета-бензолсульфокислоты с 90%-ной серной кислотой при 235оС приводит к равновесной смеси, состоящей из 66% мета- и 34% пара-бензолсульфокислоты.
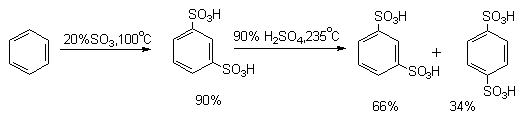
Дальнейшее сульфирование мета-бензолдисульфокислоты до 1,3,5-бензолтрисульфокислоты удается провести только с 60%-ным олеумом при 250оС в присутствии сульфата ртути. Толуол сульфируется в несколько раз быстрее бензола. При этом, как правило, образуется смесь всех трех изомерных толуолсульфокислот.
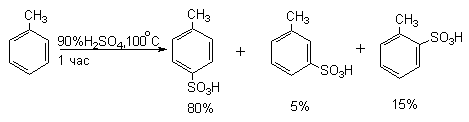
пара-Толуолсульфокислота плохо растворима в конц.HCl и может быть выделена в чистом виде путем насыщения конц. водного раствора смеси полученных сульфокислот хлористым водородом.
Сульфирование хлорбензола и других галогенбензолов протекает в десять раз медленнее, чем сульфирование бензола, в результате образуется пара-хлорбензолсульфокислота, почти не содержащая орто-изомера.
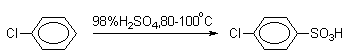
Нитробензол сульфируется 60%-ным олеумом при 80-100оС исключительно до мета-нитробензолсульфокислоты.
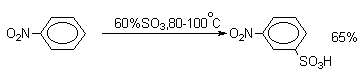
Пара-нитротолуол, как и следовало ожидать, образует при сульфировании 20%-ным олеумом 4-нитро-2-толуолсульфокислоту.
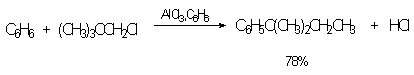
Сульфированием ароматических аминов получают аминосульфокислоты. Аминогруппа является одним из сильнейших электронодонорных ориентантов I-го рода, однако в 90-100%-ной серной кислоте или олеуме она протонируется, причем равновесие практически нацело смещено в сторону протонированной формы. Аммониевая группа NH3+ относится к сильным электроакцепторным заместителям, вызывающим резкое замедление реакции сульфирования и ориентирующим входящий электрофил в мета-положение.
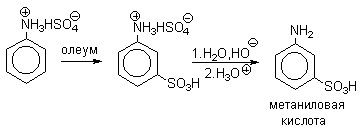
В промышленности метаниловую кислоту получают восстановлением мета-нитробензолсульфокислоты.
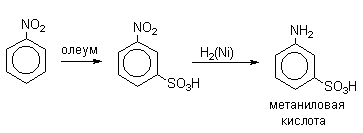
Для получения орто- и пара-аминобензолсульфокислот используют обходный метод, который носит название "реакции запекания". Эту реакцию осуществляют при длительном нагревании гидросульфатов ароматических аминов при 100-200оС в сухом виде или в высококипящих органических растворителях, обычно в орто-дихлорбензоле. При температуре около 100оС образуется практически чистый орто-изомер (ортаниловая кислота, продукт кинетического контроля), а при 180-200оС - пара-изомер (сульфаниловая кислота, продукт термодинамического контроля).
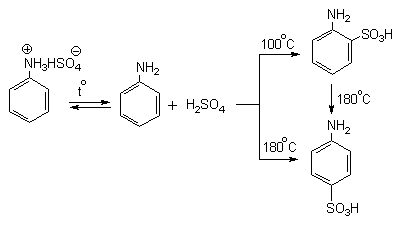
Кроме того, имеются данные, что при высоких температурах может протекать конкурентный процесс образования сульфаминовой кислоты, которая затем изомеризуется с переходом сульфогруппы в пара-положение кольца.
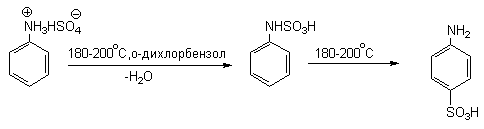
3.6.3. Свойства аренсульфокислот
Сульфокислоты, подобно карбоновым кислотам, образуют галогенангидриды, ангидриды, амиды и сложные эфиры. Методы получения этих функциональных производных по существу аналогичны методам, применяемым для получения производных карбоновых кислот. Один из методов получения хлорангидридов сульфокислот (сульфохлоридов) заключается в обработке сухой натриевой соли сульфокислоты тионилхлоридом или пятихлористым фосфором в ДМФА.
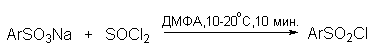
В промышленности сульфохлориды получают также прямым сульфированием аренов 4-5 эквивалентами хлорсульфоновой кислоты. Амиды и сложные эфиры сульфокислот легко получаются из сульфохлоридов с помощью стандартных методов.

Производные амида сульфаниловой кислоты (сульфамидные препараты; лекарственные вещества антимикробного действия) получают по следующей схеме:
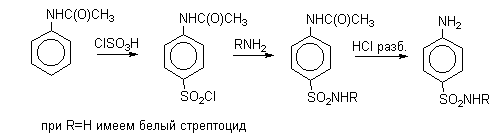
Алкилтозилаты ROTs, алкилтрифлаты CF3SO3R (ROTf) и другие алкилсульфонаты нашли широкое применение в качестве алкилирующих агентов в реакциях бимолекулярного и мономолекулярного нуклеофильного замещения.
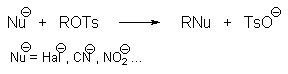
![]()
Алкилтозилаты восстанавливаются до углеводородов с помощью литийалюминийгидрида
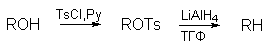
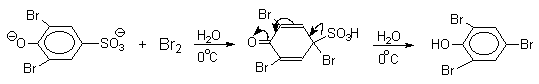
Сульфогруппа может быть замещена на нитрогруппу или галоген. Эти электрофильные реакции ипсо-замещения широко используются в органическом синтезе, например, при получении пикриновой кислоты или 2,4,6-трибромфенола
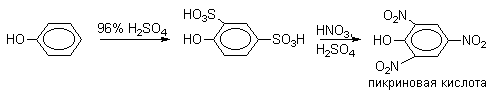
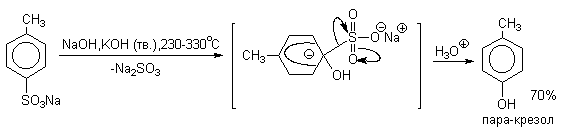
Важное значение в органическом синтезе имеют также реакции нуклеофильного замещения сульфогруппы. Сплавлением щелочных солей сульфокислот с твердыми щелочами и цианидами натрия и калия получают, соответственно, фенолы и нитрилы ароматических килот (арилцианиды).