
Лабораторная работа 1: Гальванический элемент. Определение ЭДС. Влияние концентрации растворов электролитов на ЭДС гальванического элемента.
Цель работы: овладеть методикой измерения ЭДС гальванического элемента, изучить зависимость ЭДС от активности потенциалопределяющих ионов, сравнить ход экспериментальной зависимости с теоретически рассчитанной по уравнению Нернста.
1.Теоретическая часть
Гальваническим элементом (ГЭ) называется электрохимическая система, в которой химическая энергия непосредственно превращается в электрическую. ГЭ (рис. 1) состоит из двух электродов 1 и 2 (катода К и анода А), погруженных в растворы электролитов (5 и 6),находящихся в отдельных сосудах (3 и 4) разделенных либо электролитическим ключом (7), либо диафрагмой, проницаемой для ионов. Внешняя цепь (8) может включать в себя потребитель энергии, измерительные приборы, металлические проводники.
При разомкнутой цепи в ГЭ на обоих электродах устанавливается равновесие, характеризуемое величиной соответствующих равновесных потенциалов Ер.
Для металлических электродов в растворах собственных солей потенциалопределяющей является реакция:
M(р)n+
+ n![]()
![]() M(тв).
M(тв).
Уравнение Нернста для расчета потенциала металлического электрода имеет вид:
![]() .
.
![]() -
равновесный потенциал металлического
электрода
-
равновесный потенциал металлического
электрода
![]() -
стандартный потенциал (для активностей,
равных 1)
-
стандартный потенциал (для активностей,
равных 1)
![]() -
активность потенциалопределяющих
ионов.
-
активность потенциалопределяющих
ионов.
Активность твердой фазы принимают равной единице.
Катодом в электрохимии называется электрод, на котором происходят процессы
восстановления, то есть присоединения электронов. Анодом называется электрод, на
котором идут процессы окисления, то есть отдачи электронов.
В ГЭ процессы идут самопроизвольно, поэтому при замыкании цепи
отдавать электроны будет электрод с более отрицательным потенциалом, а принимать –
электрод с более положительным потенциалом.
Разность равновесных потенциалов катода и анода называют электродвижущей силой ГЭ:
![]() .
.
Разность стандартных электродных потенциалов называют стандартной ЭДС ГЭ:
![]()
![]() .
.
Таким образом, ЭДС ГЭ есть величина положительная.
Суммарная электродная реакция в ГЭ есть сумма полуреакций, идущих на аноде и на катоде и называется токообразующей реакцией (ТОР).
Электродвижущая
сила элемента связана с энергией Гиббса
ТОР
![]() уравнением:
уравнением:
![]() ,
,
где п – число электронов, участвующих в ТОР.
В общем случае, для токообразующей реакции :
bB + dD = lL + mM,
протекающей в ГЭ
при стандартных состояниях веществ и
Т = 298 К, энергия Гиббса
![]() рассчитывается по табличным значениям
по
уравнению:
рассчитывается по табличным значениям
по
уравнению:
![]() .
.
Таким образом, стандартную ЭДС ГЭ можно определить двумя способами:
- первый способ -
по уравнению
![]() ;
;
- второй способ - используя табличные значения стандартных потенциалов.
ЭДС гальванического элемента для ТОР при активности ионов, отличных от 1 моль/л, можно рассчитать из выражения:
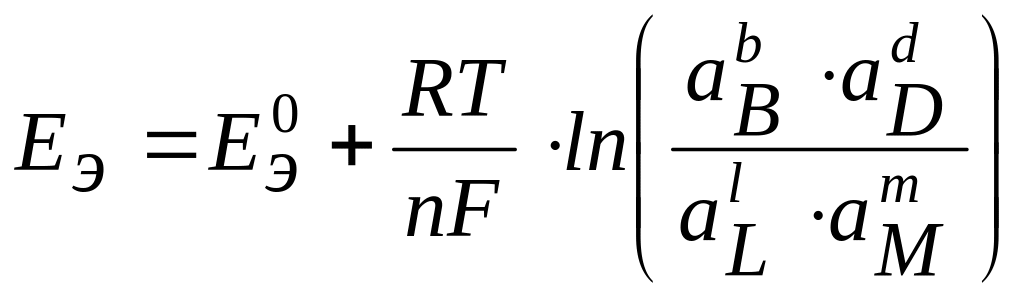 ,
,
где аВ, аD, аL , aM, – активности веществ; b, d, l, m – стехиометрические коэффициенты ТОР. Для твердых веществ активности принимают равными единице.
Максимальная
электрическая работа ГЭ определяется
соотношением
![]() ,
поскольку
,
поскольку
![]() .
.
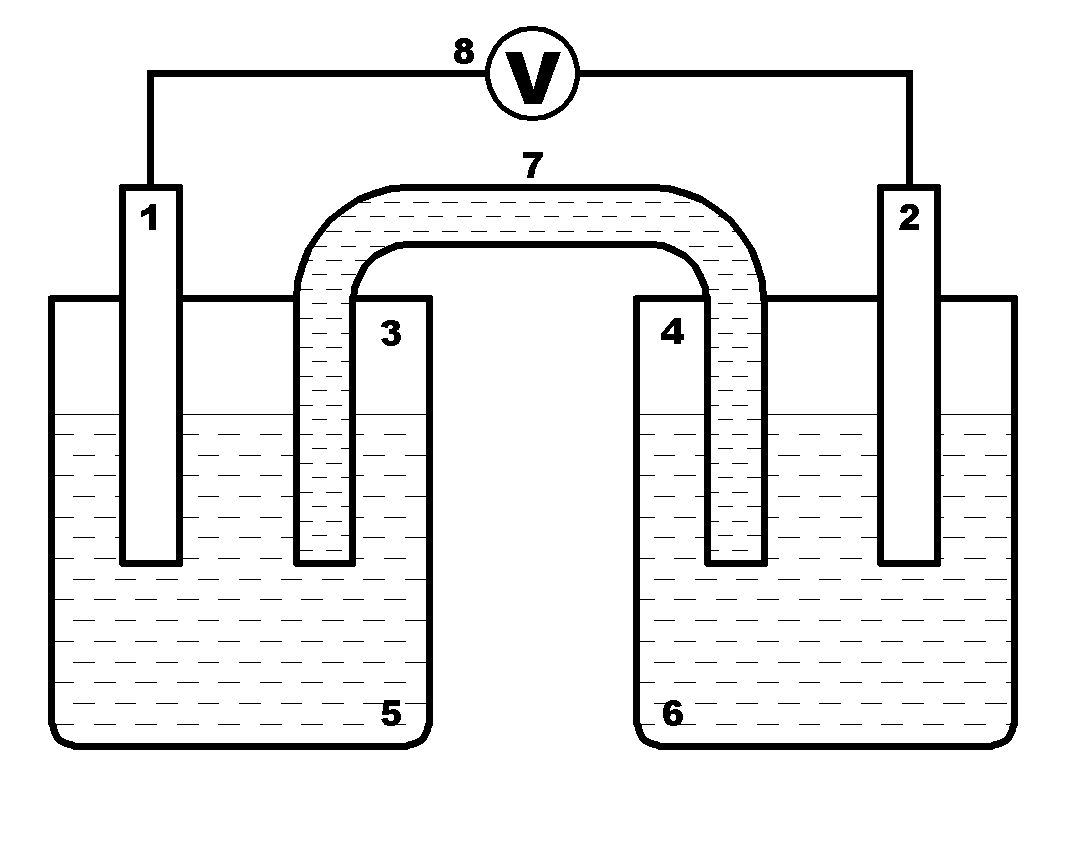
Рис 1. Устройство классического гальванического элемента
