
- •170034, Г. Тверь, пр. Чайковского, д. 9, оф. 504,
- •Список сокращений
- •Характеристика системы гемостаза
- •Морфологические компоненты системы гемостаза:
- •Сосудистая стенка
- •Эндотелий
- •Продукты эндотелиоцитов, участвующие в гемостазе
- •Контроль активности тромбоцитов
- •Тромбомодулин
- •Прокоагулянтная роль эндотелия, регуляция сосудистого тонуса
- •Роль эндотелия в регуляции сосудистого тонуса
- •Сосудистая стенка
- •Тканевой фактор
- •Коллаген
- •Тромбоциты
- •Рецепторы мембраны тромбоцитов
- •Рецепторы для высокомолекулярных белков
- •Интегрины
- •Фактор роста тромбоцитов (pdgf)
- •Фактор XIII
- •Адгезия тромбоцитов
- •Тромбоциты
- •Активация тромбоцитов
- •Агрегация тромбоцитов
- •Ретракция сгустка крови
- •Участие моноцитов в свертывании крови
- •Плазменные белки гемостаза
- •1) Многоступенчатый этап, приводящий к акти вации протромбина и превращению его в ак тивный фермент - тромбин;
- •Роль кофакторов и микроокружения в процессе свертывания крови
- •Роль кальция в гемостатических реакциях
- •Ингибиторы ферментов системы гемостаза
- •Антитромбин и гепарин
- •Протеин s
- •Система фибринолиза
- •Активатор плазминогена тканевого типа
- •Внутренний путь активации фибринолиза
- •Внешний путь активации фибринолиза
- •Ингибиторы тканевого активатора плазминогена (pai)
- •Активируемый тромбином ингибитор фибринолиза (tafi)
- •Другие элементы системы фибринолиза
- •Реологические аспекты гемостаза
- •Функция тромбоцитов в различных гемодинамических условиях
- •Современная теория свертывания крови
- •Особенности физиологии и исследования гемостаза у плодов, новорожденных и детей раннего возраста
- •Тромбоциты
- •О собенности физиологии и исследования гемостаза у женщин при менструации и беременности
- •Клинический пример 1
- •Обеспечение диагностики нарушении гемостаза в
- •Подбор антикоагулянтов
- •Динамический анализ функции тромбоцитов
- •2 Агонистов (индукторов агрегации) возможно селективное выделение аспириновых тромбоцитопа-тий. По типу измерения pfa-100 является динамическим агрегометром.
- •Тромбоцитокрит (рст)
- •Агрегация тромбоцитов
- •Клинический пример 2
- •Исследования агрегации тромбоцитов в образцах цельной крови
- •Молекулярно-биологические методы
- •Коагуляционные методы
- •Ручные методы
- •Автоматизированные коагулометры
- •Оптико-механические коагулометры
- •Турбидиметрические коагулометры
- •Нефелометрические коагулометры
- •Преимущества и недостатки различных методов обнаружения сгустка
- •Иммунохимические методы
- •Скрининговые тесты оценки плазменного звена гемостаза
- •Диагностическое значение ачтв
- •Использование ачтв для выявления волчаночного антикоагулянта
- •Контроль лечения гирудином
- •Скрининговый тест на основе ачтв для оценки антикоагулянтной активности протеина с
- •Протромбиновое время
- •3) Протромбиновое отношение (по), которое определяется как
- •Тканевые тромбопластины
- •Протромбиновый тест (пт) по Квику
- •0,5 Г/л (врожденная или приобретенная гипо/
- •Рептилазное время (батроксобиновое время)
- •Турбидиметрический метод
- •Интерпретация результатов
- •Определение фактора Виллебранда (vWf)
- •Определение фактора VII с использованием хромогенного субстрата
- •Определение протромбина (фактора II) с использованием хромогенного субстрата
- •Определение фактора XIII
- •Преаналитические факторы, влияющие на результаты определения гепарина
- •Определение протеина с
- •Определение протеина s
- •Определение антитромбина
- •Тесты аля исслелования фибринолитической системы
- •Определение α2-антиплазмина
- •Опрелеление ингибитора активатора плазминогена типа 1 (pai-1)
- •Паракоагуляционные тесты
- •Стандарты воз
- •Внутрилабораторный контроль качества
- •Патология гемостаза
- •Без правильных современных лабораторных исследований невозможно лечение и профилактика нарушений гемостаза.
- •Гемофилия а
- •Коагулограмма при гемофилии а
- •Исследование восстановления фактора VIII в крови
- •Клинический пример 3
- •500 Me 1 раз в 2 дня. Исследование коагулог-раммы через год показало отсутствие ингибитора к ф.VIII у пациента.
- •Клинический пример 4
- •Патология гемостаза
- •VWf:Ag - антиген фактора Виллебранда, vWf:rCo - коллаген-связывающая активность фактора Виллебранда, ф.VIII - фактор коагуляции VIII, а-д - аутосомно-доминантное, а-р - аутосомно-рецессивное.
- •Клинический пример 5
- •Клинический пример 6
- •Иммунная тромбоцитопеническая пурпура (итп)
- •Клинический пример 7
- •3 Недель.
- •Приобретенный ингибитор к фактору VIII (приобретенная гемофилия а)
- •Клинический пример 8
- •Приобретенный ингибитор к фактору V
- •Приобретенные ингибиторы к протромбину, факторам VII и X
- •Приобретенные ингибиторы к фибриногену, фибрину, ф.Хiii и промежуточным продуктам
- •Приобретенный дефицит витамина к
- •Лечение антикоагулянтами непрямого действия, отравление антагонистами витамина к
- •Клинический пример 9
- •Лабораторные тесты при тромбофилии
- •Клинический пример 10
- •Дефицит протеина с
- •Клинический пример 11
- •Дефицит протеина s
- •Мутация протромбина 20210а
- •Дефицит антитромбина
- •Гипергомоцистеинемия
- •Клинический пример 12
- •Высокая активность фактора VIII и фактора Виллебранда
- •Дисфибриногенемия
- •Антифосфолипидный синдром и волчаночный антикоагулянт
- •Клинический пример 14
- •110%, Ачтв 45,9 с (норма 28-40 с), активность ф.Iх 68%, ф.Хi 80%, ф.Хii 96%, ф.VIII 120%, скринин-говый тест на волчаночный антикоагулянт положительный.
- •Клинический пример 15
- •Клинический пример 16
- •Фибринолитическая терапия
- •Этиология и патогенез двс
- •Виды двс-синдрома
- •Тромбоцитарно-сосудистый гемостаз при двс-синдроме
- •Плазменный гемостаз при двс-синдроме
- •И фазы двс-синдрома
- •Клинический пример 18
- •Наиболее значимые факторы патологического тромбообразования у детей первого полугодия жизни
- •Приложение
- •Новорожденных в первые 6 месяцев жизни
- •В течение первых 6 месяцев жизни
- •У детей первых 6 месяцев жизни
- •По сравнению с взрослыми
- •По сравнению с взрослыми
- •Обеспечение качества лабораторной
- •Вторичные комплексные нарушения
Плазменные белки гемостаза
Плазменные белки гемостаза образуют 2 ферментативные системы крови, имеющие своей целью поддержание гемостатического баланса (рис. 31):
Система свертывания плазмы. Система со стоит из ферментов, неферментативных бел ковых катализаторов (кофакторов) и инги биторов свертывания. Конечной целью этой системы является образование важнейшего фермента тромбина, а в конечном итоге - фибринового сгустка, составляющего осно ву гемостатического тромба.
Система фибринолиза. Конечной целью этой системы является образование главного фер мента фибринолиза плазмина и лизис фибри нового сгустка. Эту систему составляют плаз- миноген и его активаторы и ингибиторы. Обе эти системы имеют сходные черты:
• В обеих системах происходит многоэтапный ферментативный процесс актива-
ции, в котором участвует ряд белков - про-теаз.
По крайней мере, in vitro имеется несколько путей запуска каждого процесса, а в итоге об разуется один конечный продукт.
Многие реакции нуждаются в наличии спе цифической поверхности и ионов кальция. In vivo твердой фазой для фиксации реаги рующих белков служат кислые фосфолипи- ды клеточных мембран, в частности мемб ран тромбоцитов, фибробластов, возможно лейкоцитов.
Кроме каскадных систем свертывания плазмы и фибринолиза, к плазменным белкам гемостаза относятся многочисленные ингибиторы и активаторы, эффекты которых проявляются как действие антикоагулянтов или прокоагулянтов и соответственно ингибиторов или активаторов фибринолиза.

Рис. 31. Система свертывания крови и система фибринолиза - каскадные протеолитические ферментативные системы, обеспечивающие гемостатический баланс крови
Плазменные белки гемостаза
Система свертывания плазмы
Система свертывания плазмы - ферментативная система, осуществляющая каскад протео-литических реакций, в результате которых происходит образование фибриновой пробки в месте повреждения сосуда. Система свертывания тесно связана с другими протеолитическими системами плазмы, в том числе с системой фибри-нолиза. Белки свертывания плазмы, входящие в каскад свертывания крови, принято называть термином «фактор». В соответствии с международной номенклатурой факторы свертывания плазмы обозначаются римскими цифрами (табл. 6). Активные формы факторов обозначаются теми же римскими цифрами, но с добавлением аббревиатуры «а».
Практически все факторы системы свертывания крови циркулируют в кровотоке в форме неактивных проэнзимов или в форме неактивных кофакторов. Исключение составляет фак-
тор VII, примерно 1-2% которого в норме циркулируют в активной форме. При запуске свертывания крови происходит каскадная активация проэнзимов и кофакторов (рис. 32). Процесс активации представляет собой ограниченный протеолиз неактивных предшественников до активных энзимов и кофакторов. Активированные энзимы являются сериновыми протеа-зами (за исключением фактора XIII). Активированные кофакторы, не обладая самостоятельной ферментативной активностью, играют роль коферментов.
Сериновыми протеазами являются активированные факторы II, VII, IX, X, XI, XII, ПК.
Трансглютаминаза - фактор XIII.
Кофакторы - факторы V, VIII, ВМК.
Содержание компонентов гемостаза, в том числе плазменных факторов свертывания, в системе циркуляции существенно больше, чем необходимо
Таблица
6
Плазменные
факторы свертывания крови
При разработке первой номенклатуры были использованы римские символы факторов от I до XIII. Для обозначения участия в свертывании плазмы тканевого фактора и ионов кальция им были приданы символы соответственно III и IV. Однако в настоящее время римская нумерация для них не используется, так как они не относятся к плазменным факторам свертывания (тканевой фактор - это тканевой компонент вне сосудистой системы, ионы Са не являются белком). Фактор VI в классификации не употребляется, так этим символом ошибочно был назван фактор Va.
Плазменные белки гемостаза

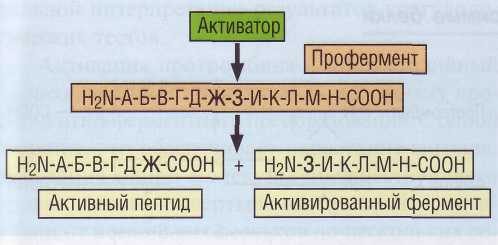
Рис. 32. Протеолитическая активация факторов гемостаза. Путем ограниченного протеолиза из неактивного предшественника образуются активный пептид и активированный фермент
для формирования фибринового сгустка. Процесс свертывания происходит в условиях насыщения субстратами (рис. 33). Вследствие этого образование гемостатического тромба может быть достигнуто при значительном диапазоне концентрации и активности конкретного фактора свертывания. Клинические проявления недостаточности компонентов свертывания возникают при их существенном уменьшении, если обратиться к рис. 33 - то это начальный диапазон, при котором скорость реакции зависит от концентрации фактора.
Для эффективного взаимодействия и активации белков свертывания крови необходимо образование комплексов этих белков, их кофакторов и субстрата (рис. 34). Эти условия не могут возникнуть в жидкой фазе. Поэтому большинство процессов активации промежуточных факторов свертывания протекают на фосфолипидах клеточных мембран. В месте сборки комплексов происходит концентрация факторов свертывания. Здесь же присутствуют кофакторы, которые существенно ускоряют процесс формирования сгустка. В создании активного комплекса участвуют:
Фермент (активный плазменный фактор - протеолитический фермент).
Субстрат (профермент).
Активированный кофактор.
Ионы Са (Са2+).
Кислые фосфолипиды и специфические ре цепторы на поверхности клеток.
Все белки системы свертывания крови можно разделить на две группы. Одни белки для полноценного формирования требуют наличия витамина К (витамин-К-зависимые белки), а другие - нет.
Рис. 33. Соотношение между концентрацией факторов и скоростью процесса свертывания. В норме скорость коагуляции практически не определяется концентрацией факторов, так как они присутствуют в избытке и процесс идет в состоянии насыщения. Только после значительного истощения фактора его концентрация будет влиять на скорость реакции и соответственно на скорость свертывания плазмы

Рис. 34. Модель сборки комплекса факторов свертывания крови. На поверхность твердой фазы (фосфолипиды фибробластов, макрофагов, активированных тромбоцитов либо, в патологических ситуациях, мембраны поврежденных клеток, бактерий и др,) прикрепляется (интернали-зуется) крупный кофакторный белок, который организует место контакта факторов свертывания, те в свою очередь взаимодействуют друг с другом по принципу комплементарности
Плазменные белки гемостаза
Витамин-К-зависимые белки

Витамин-К-зависимыми белками являются ф.II, -VII, -IX, -X, протеины С и S. Эти белки синтезируются в печени и имеют сходную структуру молекулы (рис. 35). Характерной их особенностью является наличие уникальной аминокислоты -у-карбоксиглутамина. Эта аминокислота образуется во время синтеза витамин-К-зависимых белков в печени путем у-карбоксилирования глута-мина ферментом у-карбоксиглутаминпептидазой, в работе которого принимают участие активированные формы витамина К (рис. 142). у-карбок-сиглутамин дает возможность витамин-К-зависи-мым белкам с помощью ионов Са2+ образовывать комплексы с кислыми фосфолипидами.
Рис. 35. Структурная организация некоторых плазменных белков системы гемостаза. Стрелками показаны места протеолитического гидролиза, в результате которого происходит переход неактивных проферментов в активные ферменты - сериновые протеазы каскада коагуляции. Двузубцем обозначены витамин-К-зависимые факторы, имеющие в своей структуре карбоксилированную глюта-миновую кислоту
Неферментные активаторы свертывания крови
К неферментным активаторам свертывания крови (коферментам) относятся факторы V и VIII. Оба - высокомолекулярные белки, имеющие сходную структуру. Они циркулируют в плазме в неактивной форме и активируются тромбином. ф.VIII в плазме связан с фактором Виллебранда (vWF), который защищает его от преждевременной инактивации. Диссоциация фVIII из комплекса с vWF происходит под воздействием тромбина (рис. 25).
ф.Va и -Villa образуют на фосфолипидных мембранах комплексы с ф.Ха и -IХа соответственно. Специфическая активность ф.Ха и -IХа в комплексах с кофакторами в десятки тысяч раз больше, чем изолированных. Основным ингибитором ф.Va и -VIIIa является комплекс протеин С - протеин S.
Классический коагуляционный каскад активации тромбина
Изучение процесса свертывания крови до настоящего времени происходит в основном in vitro в смоделированных условиях. Исследование взаимодействия плазменных белков гемостаза в отрыве от других компонентов привело к созданию так называемой «классической» теории коагуля-ционного каскада активации тромбина. В насто-
ящее время эта теория пересмотрена с учетом вновь полученной информации о взаимодействии различных компонентов гемостаза. Однако базовые принципы изложенной ниже классической каскадной теории считаются верными до настоящего времени. Кроме того, знание классического каскада свертывания крови необходимо для пра-
Плазменные белки гемостаза
вильнои интерпретации результатов коагулоло-гических тестов.
Активация протромбина - многостадийный процесс, который происходит по механизму про-ферментно-ферментного преобразования. С одной стороны, это обеспечивает нарастание сигнала: активация одной молекулы предшествующего уровня в системе свертывания приводит к активации от нескольких десятков до нескольких сотен тысяч последующих молекул (рис. 36). С другой стороны, многостадийность позволяет более гибко регулировать процесс.
В классическом каскаде свертывания крови выделяют 2 пути активации процесса:
Рис. 36. Каскадный принцип усиления сигнала. Каждый предыдущий компонент системы свертывания активирует много последующих
Активация тканевым фактором (ТФ). Так как ТФ не относится к плазменным факторам и контактирует с кровью только при повреж дении сосуда, то активация с его участием обозначается как внешний путь свертывания.
Активация ф.ХII при контакте с отрицатель но заряженной поверхностью твердого тела, или контактная активация. Поскольку фак тор XII в норме присутствует в плазме, акти вация с его участием обозначается как внут-

ренний путь свертывания (все факторы присутствуют в плазме в норме). Внешний и внутренний пути взаимодействуют между собой, а их разделение достаточно условно. Внешний и внутренний пути сходятся на факторе X. Последний со своим кофактором ф.Vа образует протромбиназу - ферментативный комплекс, который активирует протромбин с образованием тромбина. Образовавшийся тромбин поступает в ток крови и активирует фибриноген до фибрин-мономеров. Последние спонтанно соединяются, образуя полимеры фибрина. Условно свертывание плазмы (крови) делится на 2 основные фазы:
