
- •Контрольная работа Окислительно-восстановительные реакции
- •1. Определите сумму коэффициентов в молекулярном уравнении овр:
- •2. Определите равновесный потенциал электрода, на котором протекает реакция
- •5. Установите, в каком направлении возможно самопроизвольное протекание реакции
- •6. Вычислите константу равновесия системы:
- •7. Решите задачу, используя закон эквивалентов.
- •Задания для самостоятельной работы
- •Литература
- •Темы рефератов.
Контрольная работа Окислительно-восстановительные реакции
Вариант 0.
1. Определите сумму коэффициентов в молекулярном уравнении ОВР:
KBrO3+F2+KOH→KBrO4+
а) 7 б) 23 в) 8 г) 12
2. Определите равновесный потенциал электрода, на котором протекает реакция
ClO4- + 2H+ + 2e ÛClO3− + 2H2O
Стандартный потенциал равен + 1,19 В, активности ионов ClO3- и ClO4- соответственно 0,75 и 1,55 моль/л, рН = 4.5, Т =298 К
3. Какая из восстановленных форм
а) H2S б) Mn2+ в) Cu
является более активным восстановителем:
1) S+2H++2e=H2S φ0=0,17В
2) MnO4-+8H++5e=Mn2++4H2O φ0=1,51В
3) Cu++e=Cu φ0=0,52В
4. Используя табличные значения, определите, какой наиболее вероятный продукт образуется при окислении хлорид-ионов в нейтральной среде под действием перманганат-ионов, если концентрации веществ в растворе равны 1 моль/л.
1) MnO4-+4H++3e=MnO2+2H2O φ0=1,67В
2)2Cl-=Cl2+2e φ0=1,36В
3) Cl-+H2O=HClO+H++2e φ0=1,49В
4) Cl-+3H2O=ClO3-+6e+6H+ φ0=1,45В
а) HClO б) Cl2 в) ClO3-
5. Установите, в каком направлении возможно самопроизвольное протекание реакции
2NaCl+Fe2(SO4)3=2FeSO4+Cl2+Na2SO4
1) Cl2+2e=2Cl- φ0=1,36В
2) Fe3++e=Fe2+ φ0=0,77В
а) слева направо б) справа налево в) обратима
→ ← ↔
6. Вычислите константу равновесия системы:
2CoCl3=2CoCl2+Cl2
а) 2 б) 1·1016 в) 2·1016 г) 16
7. Решите задачу, используя закон эквивалентов.
Определить массу выделившегося йода при взаимодействии 0,5 л 15%-ного раствора иодида калия (плотность - 1,12 г/мл) в кислой среде с избытком перекиси водорода.
Примеры решения некоторых задач
Окислительно-восстановительными называются реакции, сопровождающиеся изменением степени окисления элементов.
Степень окисления равняется условному заряду атома элемента, определенному исходя из предположения, что молекула состоит только из ионов.
При определении степени окисления атомов в соединениях следует знать:
1. Степень окисления
атомов входящих в состав молекул простых
веществ
![]() ,
равна нулю, так как ни частичный, ни
полный переход электронов одного атома
к такому же другому невозможен.
,
равна нулю, так как ни частичный, ни
полный переход электронов одного атома
к такому же другому невозможен.
2. Некоторые элементы во всех сложных веществах имеют постоянную степень окисления:
а) Щелочные металлы (Li, Na, K, Rb, Cs, Fr) имеют степень окисления +1
б) Элементы II группы (кроме Hg)
Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd имеют степень окисления +2
в) Алюминий Al имеет степень окисления +3
г) Фтор F имеет степень окисления –1
д) Водород(H) имеет степень окисления равную +1 , во всех соединениях,
кроме гидридов, которые он образует со щелочными и щелочноземельными металлами. В гидридах степень окисления водорода равна -1(H2O2, N2O2, BaO2).
е) Степень окисления кислорода(O) равняется –2.
Исключение
составляют пероксиды, надпероксиды
и супероксиды. Например, в
![]() степень окисления кислорода составляет
соответственно – 1, –1/2 и –1/3 , а во
фториде кислорода ОF2
степень окисления равна +2.
степень окисления кислорода составляет
соответственно – 1, –1/2 и –1/3 , а во
фториде кислорода ОF2
степень окисления равна +2.
4. Степень окисления атома в сложном соединение может быть определена, если известны степени окисления атомов других элементов, входящих в соединение, исходя из того, что алгебраическая сумма степеней окисления, всех атомов составляющих молекулу, равна нулю. В случае иона алгебраическая сумма степеней окисления составляющих этот ион атомов, равняется заряду иона.
Например, даны
![]() .
Для определения степени окисления серы
и азота составим уравнение: (+1)∙2 + х +
(-2) ∙ 4 = 0; х = 6, степень окисления S
= 6
.
Для определения степени окисления серы
и азота составим уравнение: (+1)∙2 + х +
(-2) ∙ 4 = 0; х = 6, степень окисления S
= 6
y + (-2) ∙ 3 = -1; у = +5, степень окисления N = 5
Не следует отождествлять степень окисления с валентностью элемента, даже если их абсолютное значение совпадают. Валентность атома определяется числом химических связей, и не имеет знака.
Например, во всех
соединениях
![]() валентность
углерода равна 4, а степень окисления
составляет соответственно -4, -2, 0, +1.
валентность
углерода равна 4, а степень окисления
составляет соответственно -4, -2, 0, +1.
Принято считать, что изменение степеней окисления атомов в результате окислительно-восстановительной реакции связано с переходом электронов от одного атома к другому.
Процесс отдачи электронов называться окислением. Вещество, атомы которого отдают электроны, называется восстановителем. Восстановитель в результате реакции окисляется, степень окисления его повышается, соответственно числу отданных электронов.
Процесс присоединение электронов называется восстановлением. Вещество, атомы которого принимают электроны, называется окислителем. Окислитель в результате реакции восстанавливается, степень окисления его понижается соответственно числу принятых электронов.
Так, в реакции
![]()
восстановителем является хлорид олова (II). Степень окисления иона олова увеличивается от +2 до +4.
Степень окисления иона железа в ходе реакции понижается от +3 до +2, хлорид (III) является окислителем.
Каждая окислительно-восстановительная реакция представляет собой единство двух противоположных одновременно протекающих процессов: окисления и восстановления.
Пример. Расставьте коэффициенты, укажите: окислитель и восстановитель, что окисляется, что восстанавливается:
Решение.
Определяем степени окисления элементов, окислитель и восстановитель :
![]()
в-ль, т.к. о-ль, т.к. понижает
повышает степ. окисления
степ. окисл.
2) Записываем уравнение электронного баланса.
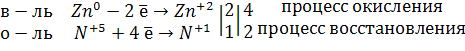
не можем поставить у N2O коэффициент 1, поэтому умножаем все коэффициенты на 2.
Часть атомов азота в HNO3 проявляет свойства окислителя, а часть выполняет роль кислой среды, поэтому коэффициент у HNO3 определяется суммой двух составляющих/
![]()
![]()
При определении продуктов окислительно-восстановительной реакции надо вспомнить, что
Только восстановительными свойствами обладают:
- все металлы; наиболее активными восстановителями являются металлы S-электронного семейства;
- вещества, в
которых атомы элементов проявляют свою
низшую степень окисления, имея завершенный
слой ns2np6,
(низшая степень окисления неметаллов
= №группы – 8) эти атомы могут только
отдавать электроны, например:
![]() .
.
Только окислительными свойствами обладают:
- ![]() (самый электроотрицательный элемент)
(самый электроотрицательный элемент)
- вещества, в которых атомы элементов находятся в высшей степени окисления (высшая степень окисления, как правило, равняется номеру группы периодической системы, к которой относится данный элемент). Например, в молекулах
![]() ,
внешний электронный слой атомов в
высшей степени окисления имеет
конфигурацию ns0np0,
т.е полностью лишен электронов.
,
внешний электронный слой атомов в
высшей степени окисления имеет
конфигурацию ns0np0,
т.е полностью лишен электронов.
Двойственными
окислительными и восстановительными
свойствами обладает вещества,
содержащие атомы в промежуточной степени
окисления, которую они могут повышать,
окисляясь и проявляя при этом
восстановительные свойства, а также
понижать, восстанавливаясь и проявляя
окислительные свойства. Это все неметаллы,
кроме
![]() ,а
также сложные вещества:
,а
также сложные вещества:
![]() и др.
и др.
Характер взаимодействия между одними и теми же веществами может изменяться в зависимости от pH среды. Это наглядно проявляется в реакциях восстановления перманганата калия одним и тем же восстановителем, например, сульфитом натрия.
окисленная форма восстановленная форма

 кислая
среда , pH<7
кислая
среда , pH<7
![]() Бесцветный раствор
Бесцветный раствор
Бурый осадок

![]()

![]()
![]()
![]()
Р-р зеленого цвета

Влияние концентрации реагентов и температуры четко прослеживается при взаимодействии металлов с серной кислотой. Так, при растворении цинка в разбавленной кислоте, в качестве окислителя выступает ион водорода:
![]()
В концентрированной же кислоте окислительные
свойства проявляет сера со степенью
окисления +6:
концентрированной же кислоте окислительные
свойства проявляет сера со степенью
окисления +6:
![]()
Во многих случаях продукты окислительно-восстановительных процессов можно определить экспериментально по наблюдениям, если продукты реакции имеют характерную окраску, выпадают в осадок, выделяются в виде газа, имеют специфический запах. В тех случаях, когда реакция не сопровождается видимыми изменениями, необходимо прибегнуть к логическому рассуждению.
В этом случае может быть полезна таблица. В левой графе даны окислители, стрелкой показано, какой продукт получается из данного окислителя при восстановлении. В правой графе приведены восстановители и продукты их окисления. В таблице также учтено влияние концентрации кислоты и характера среды.
Таблица 1
Наиболее часто применяемые восстановители и окислители, и продукты реакции
Окислители |
Восстановители |
Соединения серы |
|
|
|
Соединения азота |
|
|
|
Соединения хрома |
|
|
|
Соединения марганца |
|
|
|
Количественной характеристикой самопроизвольного протекания окислительно – восстановительной реакции является расчетное значение ∆φ о реакции, которое определяется как разность между потенциалами окислителя и восстановителя. Окислительно – восстановительная реакция протекает самопроизвольно, если разность потенциалов является положительной величиной. Сущность этого заключается в следующем: если мысленно обособить процессы окисления и восстановления, т.е. “составить” гальванический элемент, то в нем будет совершаться электрическая работа за счет протекания химической реакции. Для обратимого процесса справедливо: А (максимально полезная)=А (электрическая), но
А (электрическая) = n F Ео, где Ео - стандартная ЭДС, В;
Ео (∆φ о) = φ оокислителя - φ о восстановителя,
(рассчитываем для той реакции, которая протекает самопроизвольно, т.е. при расчете А-работы ЭДС должна быть положительно).
Из термодинамики известно, что А = - ∆ Gо, отсюда n F Ео = - ∆ Gо
Таким образом, изменение энергии Гиббса будет отрицательной величиной, а значит, реакция будет протекать самопроизвольно, при положительном значении разности потенциалов.
Константу равновесия редокс-процесса можно рассчитать, исходя из соотношения:
![]() ;
;
![]() ;
;
![]() .
.
Примеры решения заданий варианта контрольной работы
