
Флуоресценция
Флуоресценция — физический процесс, разновидность люминесценции. Флуоресценцией обычно называют излучательный переход возбужденного состояния с самого нижнего колебательного уровня S1 в основное состояние S0. Типичное время жизни такого возбужденного состояния составляет 10−11−10−6 с.
В излучение, имеющее после окончания возбуждения длительность порядка 1 с, практически всегда является фосфоресценцией.
Если, однако, времена жизни имеют промежуточные значения, например, заключены в интервале 10-1 − 10-5 с, то это явление можно отнести как к длительной флуоресценции (спонтанный переход, запрещенный в дипольном приближении), так и к быстрой фосфоресценции (обусловленной ловушкой, имеющей очень малую глубину).
Провести различия между обоими указанными случаями можно, изучив длительность послесвечения как функцию температуры. Время жизни флуоресценции не зависит или мало зависит от температуры: а температурная зависимость фосфоресценции очень сильная.
Термин «флуоресценция» происходит от названия минерала флюорит, у которого она впервые была обнаружена, и лат. -escent — суффикс, означающий слабое действие
Впервые флуоресценцию соединений хинина наблюдал физик Джордж Стокс в 1852 году.
Согласно представлениям квантовой химии, электроны в атомах расположены на энергетических уровнях. Расстояние между энергетическими уровнями в молекуле зависит от её строения. При облучении вещества светом возможен переход электронов между различными энергетическими уровнями. После поглощения света часть полученной системой энергии расходуется в результате релаксации. Часть же может быть испущена в виде фотона определённой энергии. (Приложение3.1)
Спектр флуоресценции сдвинут относительно спектра поглощения в сторону длинных волн. Это явление получило название «Стоксов сдвиг». Его причиной являются безызлучательные релаксационные процессы. В результате часть энергии поглощенного фотона теряется, а испускаемый фотон имеет меньшую энергию, и, соответственно, большую длину волны.(Приложение 3.2)
Схематически процессы поглощения света и флуоресценции показывают на диаграмме Яблонского.
При нормальных условиях большинство молекул находятся в основном электронном состоянии. При поглощении света молекула переходит в возбужденное состояние. При возбуждении на высшие электронные и колебательные уровни избыток энергии быстро расходуется, переводя флуорофор на самый нижний колебательный подуровень состояния. Однако, существуют и исключения: например, флуоресценция азулена может происходить как из, так и из состояния.
Квантовый выход флуоресценции
Квантовый выход флуоресценции показывает, с какой эффективностью проходит данный процесс. Он определяется как отношение количества испускаемых и поглощаемых фотонов. Квантовый выход флуоресценции может быть рассчитан по формуле:
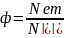
где Nem— количество испускаемых в результате флуоресценции фотонов, а Nabs — общее количество поглощаемых фотонов. Чем больше квантовый выход флуорофора, тем интенсивнее его флуоресценция. Квантовый выход можно также определить с помощью упрощенной диаграммы Яблонского.(Приложение4.1)
Тогда доля флуорофоров, возвращающихся в основное состояние с испусканием фотона, и, следовательно, квантовый выход:
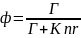
Из
последней формулы следует, что Ф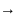 1 если,
1 если,
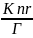 то
есть, если скорость безызлучательного
перехода значительно меньше скорости
излучательного перехода. Отметим, что
квантовый выход всегда меньше единицы
из-за стоксовых потерь.
то
есть, если скорость безызлучательного
перехода значительно меньше скорости
излучательного перехода. Отметим, что
квантовый выход всегда меньше единицы
из-за стоксовых потерь.
