
- •Экзаменационные вопросы по дисциплине «Неорганическая химия».
- •Перечень вопросов.
- •Варианты заданий для тестовой работы.
- •28 ) Нейтральную среду имеет водный раствор:
- •30 ) Реакция ионного обмена идёт до конца в результате образования нерастворимого в воде вещества при взаимодействии:
- •31) Суммы всех коэффициентов в полном и сокращённом ионном уравнениях реакции нитрата железа (ӏӏ ) с гидроксидом натрия равны соответственно:
- •39) Легче всего присоединяет электроны атом
- •40) Ионная химическая связь характерна для каждого из веществ, указанных в ряду:
- •41) Установить соответствие между названием вещества и классом ( группой) вещества, к которому ( ой) оно принадлежит:
- •42. Вещества, которые диссоциируют только на катионы металла и гидроксид- ионы, являются:
- •43. В водном растворе ступенчато диссоциирует:
- •Перечень наглядных пособий, справочных материалов, нормативных документов и т.Д. Разрешённых к использованию на экзамене.
РАССМОТРЕНО |
УТВЕРЖДАЮ |
на заседании кафедры математических и естественнонаучных дисциплин |
Заместитель директора по учебной работе |
протокол № 3 |
_____________________В.Ю. Лобов |
от «_08_» __ноября 2012 года |
«___»________________20__г. |
Председатель ______ (О. Н. Шапошникова) |
________ «___»________________20__г. |
РАЗРАБОТАЛ Н. С. Любимова |
________ «___»________________20__г. |
Преподаватель ______ ( Н. С. Любимова)
|
________ «___»________________20__г. |
«_23» октября 212г. |
________ «___»________________20__г. |
Экзаменационные вопросы по дисциплине «Неорганическая химия».
Форма обучения |
Шифр спец. |
группа |
Форма проведения |
Кол-во студентов на экзамене |
Количество вопросов |
Количество ПЗ |
очная |
240404 |
11Н |
тест |
39 |
30 |
- |
Перечень вопросов.
1.Строение молекулы воды, их дипольный характер.
2.Степень константы диссоциации. Сильные и слабые электролиты.
3.Диссоциация солей, кислот, оснований.
4.Реакции ионного обмена в растворах электролитов. Условия течения реакций до конца.
5.Оксиды в свете ТЭД. Свойства, получение.
6.Кислоты в свете ТЭД. Свойства, получение.
7.Основания в свете ТЭД. Свойства, получение.
8.Амфотерные гидроксиды.
9.Средние соли в свете ТЭД. Свойства, получение.
10.Кислые соли в свете ТЭД. Свойства, получение.
11.Основные соли в свете ТЭД. Свойства, получение.
12. Генетическая связь классов неорганических соединений.
13.Гидролиз солей. Электролитическая диссоциация воды. Ионное произведение воды. Понятие о рН.
14.Степень и константа гидролиза, факторы, влияющие на них.
15.Окислительно-восстановительные свойства элементов и их положение в периодической системе.
16.Важнейшие окислители и восстановители. Виды ОВР.
17.Метод электронно – ионного баланса. Составление уравнений ОВР в кислой среде.
18.Составление уравнений реакций ОВР в щелочной среде.
19.Упражнения на состояние уравнения ОВР методом электронно-ионного баланса в нейтральной среде.
20.Виды окислительно-восстановительных реакций.
21.Важнейшие окислители и восстановители.
22.Положение окислителей и восстановителей в периодической системе.
23.Изменение окислительно-восстановительных свойств элементов с изменением степени окисления.
24. Алгоритм составления электронно-ионного баланса.
25.Способы получения средних солей.
26.Расчёт для приготовления растворов массовой доли (W %) из твердого вещества.
27.Расчёт для приготовления растворов молярной концентрации (С) из твердого вещества.
28.Расчёт для приготовления растворов молярной эквивалента (С1/Z) из твердого вещества.
29.Классификация неорганических соединений. Определение, примеры, номенклатура.
30.Рассчет для приготовления растворов молярной эквивалента (С1/Z) из концентрированного раствора.
Варианты заданий для тестовой работы.
1) Молекулярная масса Na3PO4 равна:
1) 98 2) 134 3)168 4)164
2. Из приведённых веществ выберите простое:
1) N2 2) KOH 3) CO2 4) H2SO4
3. Объём газообразного ( парообразного) вещества количеством 1 моль (Vm) равен:
1) 22,4л/ моль 2) 2,24л/ моль 3)0,24л/ моль 4)6,02л/ моль
5. Массовая доля( в %) кислорода в следующем соединении CaCO3 равна :
1) 48 2) 16 3) 32 4) 56
6.Число структурных единиц в 1 моле любого вещества (Na) равно:
1) 22,4 *1023 2) 6,02*1023 3)60,02*1023 4) 3,02*1023
7. Сформулировал «Закон сохранения массы вещества и энергии»:
1) Ломоносов 2) Пруст 3) Авогадро 4) Менделеев
8. Молекулярная масса газа , если 5,6 л его при н.у. имеет массу 16 г равна ?
1) 44 2) 64 3) 32 4) 28
9. Плотность какого газа по воздуху равна 1,58?
1)N O 2) NO 3) NO 4) CO
10. Масса молекулярного водорода количеством вещества 5 моль равна:
1) 2 2) 5 3) 10 4) 7
11. Объём, занимаемый при н.у. 4 г СН4 равен:
1) 89,6 2)44,8 3) 22,4 4) 67,2
12) Номер периода в Периодической системе химических элементов Д.И. Менделеева равен числу:
1) электронов в атоме 4)электронных слоёв в атоме
2)электронов во внешнем слое атомов
3) недостающих электронов до завершения внешнего электронного слоя ( уровня)
13 ) Неметаллические свойства элементов усиливаются в ряду:
1) CI –S – P - Si 2) N – P – As - Se 3) B – C – N - O 4) C - Si –P – N
14 ) Кристаллическая решётка углекислого газа (CO2):
1)атомная 2) металлическая 3) ионная 4) молекулярная
15 ) Ковалентная неполярная химическая связь характерна для каждого из веществ, указанных в ряду:
1) хлороводород, водород, кислород; 3) бром, кислород, водород;
2) кислород, сероводород, сера; 4) угарный газ, метан, хлороводород
16 ) Атом наиболее активного металла имеет электронную конфигурацию?
1)……4S24p2 2) ……..4S1 3) ………. 5S1 4) ……….5S25p2
17) Атому магния (Mg) принадлежит следующая электронная формула:
1) 1S22S22P63S23P2 2) 1S22S22P63S23P1 3) 1S22S22P63S2 4) 1S22S22P63S23P3
18 ) При увеличении температуры на каждые 100 скорость большинства реакций:
1) увеличивается в 2-4 раза 3) увеличивается в 10 раз
2) увеличивается в 100 раз 4) не изменяется
19 ) С наибольшей скоростью протекает реакция раствора серной кислоты с
1) медью 2) цинком 3) магнием 4) железом
20 ) При увеличении
концентрации исходных веществ в 3 раза
скорость химической реакции
2NO(Г)
+ O2(Г)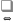 2NO2(Г)
:
2NO2(Г)
:
1) увеличится в 9 раз 2) не изменится 3) увеличится в 27 раз 4) уменьшится в 3 раза
21) Смещению равновесия в сторону исходных веществ способствуют факторы:
2NH3(г) + 3CI2(г) = N2(г) + 6HCI(г) +Q ;
1) повышение температуры
2) понижение температуры
3) повышение концентрации исходных веществ
4) влияние катализатора
22) При повышении температуры от 20 С до 50 С, если j = 2 скорость химической реакции:
1) увеличится в 8 раз 2) не изменится 3) уменьшится в 9 раз 4) увеличится в 4 раза
23 ) Для увеличения скорости реакции между газообразными веществами необходимо:
1) повысить температуру и давление 3) повысить давление и понизить температуру
2) понизить температуру и давление 4) понизить давление и повысить температуру
24 ) Из перечисленных веществ двухосновной кислотой является:
1) H2SO4 2) HCl 3) HF 4) HNO3
25) Выберите формулу основного оксида:
1) SO3 2) BaO 3) AI2O3 4) CO2
26 ) Выберите из перечисленных веществ растворимое основание:
1) NaOH 2) Fe(ОН)2 3)Cu(OH)2 4) AI(OH)3
27) Установите соответствия между химическими реакциями и сокращёнными ионными . уравнениями:
1) Ca(OH)2 + HCI → A) NH4+ + OH- →NH3+ H2O
2) NH4CI + NaOH → B) AI3+ + 3 OH- →AI(OH)3
3) AICI3 + KOH → C) H+ + OH- → H2O
4) BaCI2 + Na2SO4 → D) SO42-+ Ba2+ → BaSO4
1 |
2 |
3 |
4 |
|
|
|
|
