
- •Основные законы химии
- •Строение атома.
- •Химическая связь. Строение молекул.
- •Элементы химической термодинамики.
- •1 Порядок
- •2 Порядок
- •Химическое равновесие и закон действующих масс.
- •Растворы
- •Осмотическое давление.
- •Индикаторы
- •Гидролиз
- •Взаимно-усиливающий гидролиз
- •Окислительно-восстановительные реакции.
Осмотическое давление.
Осмос – явление проникновения растворителя в раствор через полунепроницаемую перегородку.
Осмотическое давление – это давление,
которое нужно оказать на раствор, чтобы
осмос прекратился. Явление осмоса
вызвано односторонней диффузией.
![]() .
.
Растворы электролитов.
Для электролитов
![]() .
.
![]() .
.
![]() .
.
1862 год Сванге-Арениус: электролитическая диссоциация – процесс распада частиц молекул электролита на ионы под действием молекул растворителя.
Степень диссоциации
![]() ,
где n – число растворившихся
молекул, а n0 –
исходное число молекул.
,
где n – число растворившихся
молекул, а n0 –
исходное число молекул.
Степень диссоциации электролита
зависит от: 1) от природы растворителя
(проявляется через диэлектрическую
проницаемость
![]() );
2) от природы растворенного вещества и
концентрации при данной T.
);
2) от природы растворенного вещества и
концентрации при данной T.
По степени диссоциации электролиты делят на сильные, слабые, средней силы.
Сильные:
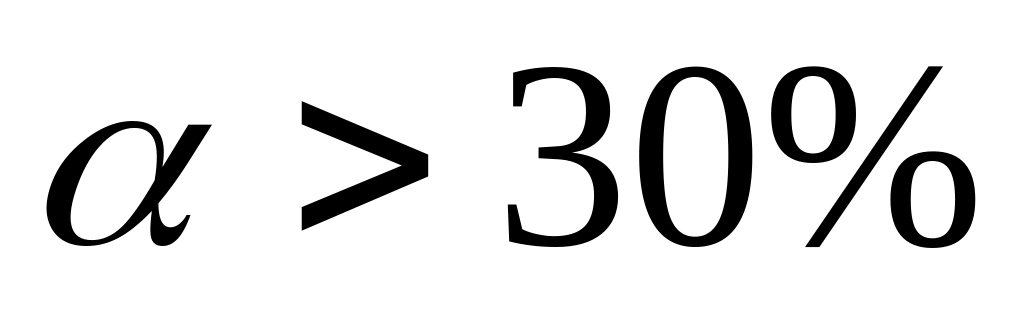 .
Неорганические к-ты (HCl,
HBr, HI,
H2SO4,HClO4,HMnO4),
основания щелочных и щелочноземельных
металлов (Ca, Sn,
Ba) и почти все соли.
.
Неорганические к-ты (HCl,
HBr, HI,
H2SO4,HClO4,HMnO4),
основания щелочных и щелочноземельных
металлов (Ca, Sn,
Ba) и почти все соли.Слабые:
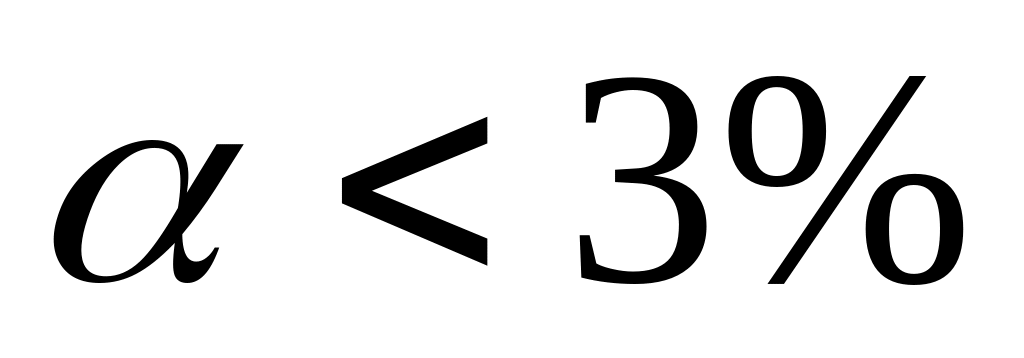 .
Неорганические кислоты (HSO3,
HF, HCN, HCNS,
H2S,
H2Se,
H3PO3),
органические кислоты, основания (NH4OH,
AlO3, PO3,d-элементы),
соли (Fe(CNS)3,
Hg2Cl2)
.
Неорганические кислоты (HSO3,
HF, HCN, HCNS,
H2S,
H2Se,
H3PO3),
органические кислоты, основания (NH4OH,
AlO3, PO3,d-элементы),
соли (Fe(CNS)3,
Hg2Cl2)Средние:
 .
Неорганические кислоты (H2CrO4,
MnO4, HCOOH,
H3PO4,
H2SO3),
основания (Mn(OH)2).
.
Неорганические кислоты (H2CrO4,
MnO4, HCOOH,
H3PO4,
H2SO3),
основания (Mn(OH)2).
С разбавлением раствора
![]() увеличивается.
увеличивается.
Слабые электролиты
![]() - разведение Оствальда, где С0 –
число образовавшихся ионов.
- разведение Оствальда, где С0 –
число образовавшихся ионов.
![]() .
.
![]() .
(Z – число частиц,
образующихся из 1 молекулы).
.
(Z – число частиц,
образующихся из 1 молекулы).
Чем меньше , тем слабее электролит.
Слабые многоосновные кислоты и многоосновные основания в водных растворах диссоциируют ступенчато.
Слабые электролиты.
В виду высокой концентрации ионов в растворах сильных электролитов образуются частицы (ассоциаты или ионные пары).
В ионных парах ионы разделены одним или более слоями.
Для растворов электролитов в качестве Д.М. применяется активность ( - термоядерная характеристика (эффективная концентрация, в соответствии с которой, ионы проявляют себя в действии))
![]() ,
где
,
где
![]() - коэффициент активности. Этот коэффициент
характеризует отклонение поведения
реального раствора от идеального. Для
учета действия всех ионов на активность
каждого из них Льюис и Рендел в 1918 году
ввели характеристику – ионная сила
раствора.
- коэффициент активности. Этот коэффициент
характеризует отклонение поведения
реального раствора от идеального. Для
учета действия всех ионов на активность
каждого из них Льюис и Рендел в 1918 году
ввели характеристику – ионная сила
раствора.
![]() ,
где
,
где
![]() - заряд i-ого иона.
- заряд i-ого иона.
Ввиду того, что нельзя экспериментально
определить коэффициент активности
отдельного иона, используют средний
коэффициент активности.
![]() - уравнение Де-Бойля и Хюпкеля.
- уравнение Де-Бойля и Хюпкеля.
Для растворов сильных электролитов в уравнение З.Д.М. включают не аналитические концентрации, а соответствующие активности ионов.
Индикаторы
Индикаторы – это вещества, изменяющие свою окраску в зависимости от характера среды. В качестве индикаторов применяют слабые кислоты или слабые основания.
![]() .
.
Индикаторы бывают: 1-цветные, 2-х цветные, 3-х цветные.
Произведение растворимости.
Абсолютно нерастворимого вещества не существует.
Произведение растворимости = ПР
ПР=ПР концентраций ионов труднорастворимого электролита в степенях, равных их числу в молекуле (справочная величина)
CaF2![]() .
.
![]() .
.
На растворимость влияет Т, природа растворителя, присутствие посторонних электронов.
Равновесие в растворах комплексных солей.
Комплексные соли в водных растворах диссоциируют на ионы внешней и внутренних сфер по типу сильных электролитов.
Ионы внутренней сферы диссоциируют по типу слабых электролитов ступенчато.
![]() .
kнест – константа
нестойкости.
.
kнест – константа
нестойкости.
![]()
Обменные реакции в растворах электролитов
Это реакции, протекающие без изменения зарядов ионов в них участвующих. Обменные реакции протекают слева направо, если в результате образуется малорастворимое, малодиссационное газообразное вещество или КС.
Малорастворимые, малодисационные, газообразные вещества записывают в виде молекул, в независимости от части уравнения. Сильные, хорошо растворимые электролиты записывают в виде ионов, несмотря на часть уравнения.
