
- •Топливо и теория горения
- •1. Информация о дисциплине
- •1.1. Предисловие
- •1.2. Содержание дисциплины и виды учебной работы
- •1.2.1. Объем дисциплины и виды учебной работы
- •Раздел 1. Топливо: виды, состав, характеристики (25 часов)
- •Раздел 2. Материальный и тепловой балансы процесса горения топлива
- •Раздел 3. Теоретические основы топочных процессов (25 часов)
- •Раздел 4. Сжигание топлива (16 часов)
- •Раздел 5. Горелочные устройства (14 часов)
- •2.2. Тематический план дисциплины
- •Тематический план дисциплины для студентов очно-заочной формы обучения
- •Тематический план дисциплины для студентов заочной формы обучения
- •2.3. Структурно-логическая схема дисциплины
- •2.4. Временной график изучения дисциплины при использовании информационно-коммуникационных технологий
- •2.5. Практический блок
- •2.5.1. Перечень лабораторных работ
- •2.5.2. Перечень практических занятий
- •2.6. Балльно-рейтинговая система оценки знаний
- •3. Информационные ресурсы дисциплины
- •3.1. Библиографический список
- •3.2. Опорный конспект лекций Введение в1. Состояние и перспективы развития топливно-энергетического комплекса Российской Федерации
- •В 2. Топливо и энергетика
- •3.2.1. Топливо: виды, состав, характеристики
- •3.2.1.1. Виды и свойства органических топлив
- •Характеристика бурых углей
- •Элементный состав и характеристики древесного топлива
- •Характеристики мазута
- •3.2.1.2. Элементарный состав топлива
- •3.2.1.3. Характеристики органических топлив
- •Вопросы для самопроверки
- •3.2.2. Материальный и тепловой балансы процесса горения топлива
- •3.2.2.1. Материальный баланс процесса горения
- •3.2.2.1.1. Стехиометрические соотношения горения топлива
- •3.2.2.1.2. Количество воздуха, необходимое для сжигания топлива
- •С техиометрические соотношения горения компонентов топлива
- •3.2.2.1.3. Состав и объем продуктов сгорания
- •3.2.2.1.4. Коэффициент избытка воздуха
- •3.2.2.2. Тепловой баланс процесса горения
- •3.2.2.2.1. Анализ уравнения теплового баланса
- •3.2.2.2.2. Тепловые характеристики продуктов сгорания
- •3.2.2.2.3 Температурные характеристики продуктов сгорания
- •Вопросы для самопроверки
- •3.2.3. Теоретические основы топочных процессов
- •3.2.3.1. Основные понятия кинетики реакций горения
- •3.2.3.1.1. Параметры смесей и химические реакции
- •3.2.3.1.2. Химическое равновесие
- •3.2.3.1.3. Кинетический закон действующих масс
- •3.2.3.1.4. Закон Аррениуса
- •3.2.3.1.5. Влияние давления и состава смеси на скорость реакции
- •3.2.3.1.6. Изменение скорости реакции во времени
- •3.2.3.2. Воспламенение и горение частицы топлива
- •3.2.3.3. Смесеобразование и горение
- •3.2.3.3.1. Смессообразование
- •3.2.3.3.2. Горение твердого топлива
- •3.2.3.4. Образование оксдов азота при горении
- •Вопросы для самопроверки
- •3.2.4. Сжигание топлива
- •3.2.4.1. Подготовка топлива к сжиганию
- •3.2.4.2. Организация сжигания топлива
- •Вопросы для самопроверки
- •3.2.5. Горелочные устройства
- •3.2.5.1. Классификация и конструкции горелок
- •3.2.5.1.1. Горелки для пылевидного топлива
- •3.2.5.1.2. Форсунки для сжигания жидкого топлива
- •3.2.5.1.3. Горелки для сжигания газа
- •3.2.5.2. Размещение горелок и работа топочных устройств
- •1 − Тангенциальной; 2 − фронтовой; 3 − встречной
- •Вопросы для самопроверки
- •Заключение
- •3.3. Глоссарий
- •3.4. Методические указания к выполнению лабораторных работ
- •Охрана труда и техника безопасности
- •Работа 1. Определение влажности топлива
- •I. Цель работы
- •II. Основные теоретические положения
- •III. Описание лабораторной установки
- •IV. Порядок выполнения работы
- •Форма 1
- •V. Содержание отчета
- •Работа 2. Определение зольности топлива
- •I. Цель работы
- •II. Основные теоретические положения
- •III. Описание лабораторной установки
- •IV. Порядок выполнения работы
- •V. Содержание отчета
- •Работа 3. Определение выхода летучих из топлива
- •I. Цель работы
- •П. Основные теоретические положения
- •Перерасчет кокса на горячую массу производят по формуле, %
- •III. Описание лабораторной установки
- •IV. Порядок выполнения работы
- •Форма 3
- •V. Содержание отчета
- •Работа 4. Определение теплоты сгорания топлива
- •I. Цель работы
- •II. Основные теоретические положения
- •III. Описание лабораторной установки
- •IV. Порядок выполнения работы
- •Форма 4
- •V. Содержание отчета
- •Работа 5. Определение содержания серы в топливе (метод «смыва бомбы»)
- •I. Цель работы
- •II. Основные теоретические положения
- •III. Описание лабораторной установки
- •IV. Порядок выполнения работы
- •Форма 5
- •III. Описание лабораторной установки
- •IV. Порядок выполнения работы
- •V. Содержание отчета
- •Приложения лр
- •3.5. Методические указания к выполнению практических занятий
- •Методические указания к выполнению контрольного задания
- •4.2. Текущий контроль Тестовые задания
- •4.3. Итоговый контроль
- •Содержание
Методические указания к выполнению контрольного задания
Выполнение расчетов горения различных топлив, составление материальных и тепловых балансов является основой инженерных расчетов, связанных с сжиганием топлива.
Схема процесса горения топлива и последующего разбавления продуктов сгорания воздухом с целью получения энергоносителя в виде горячего газа в заданном количестве и с заданной температурой показана на рис. 38.
В камеру сгорания подаются топливо и окислитель, продукты сгорания поступают в камеру смешения, где смешиваются с воздухом, полученный энергоноситель поступает к потребителю.
Для упрощения расчетов составляющие тепловых потерь заданы в процентах, потери теплоты вследствие термической диссоциации не учитываются.
 Таблица
исходных данных
Таблица
исходных данных
Параметр
Вариант
0
1
2
3
4
5
6
7
8
9
Последняя цифра
шрифта
Расход
энергоносителя Vэ,
м3/с
3,0
2,5
2,0
0,75
4,0
4,5
3,5
5,0
1,0
1,5
Предпоследняя
цифра шрифта
Температура
энергоносителя Тэ,
К
800
750
850
900
1050
1000
950
700
1200
1150
Топливо
Уголь
ирша-бородинский Б2
Уголь кузнецкий
Уголь донецкий
Сланец
Мазут малосернистый
Мазут высокосернистый
Газ природный
Серпухово-Ленинский
Газ природный
Саратов-Москва
Газ промышленный
доменный
Газ генераторный
водяной
Тепловые потери
0,0
1,0
0,5
0
0,5
0,5
0,5
0,5
0,5
0,5
0,5
2,0
3,0
0,5
0
0
0
0
0
0
0,5
1,0
1,5
2,0
0
0
0
0
0
0
через наружные
ограждения
а) камеры сгорания
0,4
0,5
1,0
1,5
2,0
2,5
3,0
3,5
4,0
5,0
б) камеры смешания
,
%
1,5
0,5
1,0
0,4
9,0
10
1,0
0,5
7,0
8,0
Третья от конца
цифра
Коэффициент
расхода окислителя, α
1,03
1,05
1,08
1,10
1,12
1,20
1,05
1,10
1,12
1,15
![]() ,
%
,
%
![]() ,
%
,
%
![]() ,
%
,
%
![]() ,
%
,
%
1) определить и выбрать необходимые для последующих расчетов характеристики топлива (состав топлива, теплота сгорания, теплоемкость);
2) рассчитать теоретический расход окислителя и теоретический выход продуктов полного сгорания топлива;
3) определить температуру газов после камеры сгорания Тк сг, К;
4) составить уравнение теплового баланса всего процесса и определить на его основе объем воздуха, необходимый для разбавления продуктов сгорания vВ, м3/кг (м3/м3) топлива;
5) составить материальный баланс процесса и определить на его основе расход топлива В, кг/с (м3/с), окислителя Vок, м3/с, и воздуха VВ, м3/с;
6) рассчитать состав продуктов сгорания (после камеры сгорания) и энергоносителя (после камеры смешения), % об.
Состав топлива, теплота сгорания, теплоемкость выбирается по справочникам. При отсутствии опытных данных для расчета приближенного значения теплоты сгорания топлива может быть использована эмпирическая формула Д.И. Менделеева:
![]() ,
,
где![]() − элементы состава рабочей массы, %.
− элементы состава рабочей массы, %.
Низшая теплота сгорания 1 м3 газового топлива, МДж/м3, определяется при нормальных условиях по его составу и теплотам сгорания индивидуальных горючих газов по формуле:
![]() ,
,
где QCO, QH2, QCH4, QCmHn, QH2S − теплота сгорания соответствующих газов, МДж/м3;
СО, Н2, СН4, СmHn, H2S − содержание соответствующих газов в сухом газовом топливе, % об.
Теоретический расход окислителя для всех видов топлива, м3/кг (м3/м3), определяется исходя из концентрации кислорода в окислителе,
![]() ,
,
где О![]() −
концентрация кислорода в окислителе,
% об.;
−
концентрация кислорода в окислителе,
% об.;
v![]() −
теоретический расход кислорода,
необходимый для полного сгорания 1 кг
твердого (жидкого) или 1 м3
газообразного топлива, м3/кг
(м3/м3).
−
теоретический расход кислорода,
необходимый для полного сгорания 1 кг
твердого (жидкого) или 1 м3
газообразного топлива, м3/кг
(м3/м3).
Для твердого (жидкого) топлива конкретного состава, м3/кг,
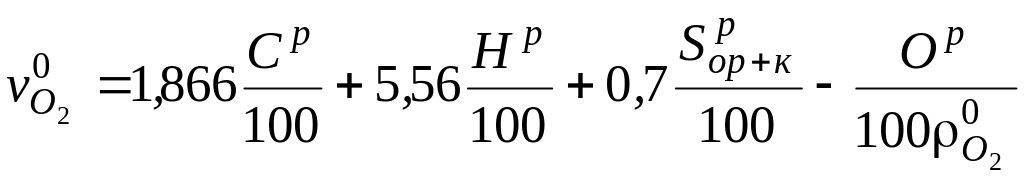 ,
,
где
![]() кг/м3
− плотность кислорода при нормальных
условиях.
кг/м3
− плотность кислорода при нормальных
условиях.
Для газового топлива известного состава, м3/м3,
![]() ,
,
где Н2, СО, СН4, СmHn, Н2S, О2 − концентрация составляющих газового топлива, % об.
При использовании воздуха в качестве окислителя его теоретический расход, необходимый для полного сгорания кг (м3) топлива, м3/кг (м3/м3), составляет:
![]() .
.
Коэффициент расхода окислителя:
![]() .
.
В общем случае для всех видов топлива суммарный выход продуктов полного сгорания, м3/кг (м3/м3), имеет вид
![]() .
.
Для твердого и жидкого топлива объемный выход:
СО2 при сгорании 1 кг углерода, м3/кг,
![]() ;
;
SO2 при сжигании 1 кг серы, м3/кг,
![]() .
.
В практике технологических расчетов принимается
![]()
и
![]() .
.
Выход азота при сжигании твердых (жидких) топлив, м3/кг, определяется в зависимости от содержания азота в топливе и окислителе
 ,
,
где
![]() =1,251
− плотность азота при нормальных
условиях, кг/м3;
=1,251
− плотность азота при нормальных
условиях, кг/м3;
N − содержание азота в окислителе, % об.
Объемное содержание кислорода в продуктах сгорания, м3/кг,
![]() . (*)
. (*)
Выход водяных паров, м3/кг, определяется из материального баланса реакции горения водорода с учетом влажности рабочей массы топлива и влагосодержания окислителя
![]() ,
,
где
![]() =
0,089 и
=
0,089 и
![]() =
0,804 − соответственно плотность водорода
и водяного пара при нормальных условиях,
кг/м3;
=
0,804 − соответственно плотность водорода
и водяного пара при нормальных условиях,
кг/м3;
dок − влагосодержание окислителя, кг/м3, сухого окислителя.
При сжигании газового топлива выход сухих трехатомных продуктов сгорания (с учетом СО2, содержащегося в исходном газовом топливе), м3/м3, составляет
![]() .
.
Выход азота, м3/м3, определяется в зависимости от содержания азота в газовом топливе и окисляется с учетом коэффициента расхода окислителя
![]() .
.
Объемное содержание кислорода в продуктах сгорания газового топлива, м3/м3, находится из выражения (*).
Выход водяных паров, м3/м3, определяется на основе химических реакций горения водородосодержащих компонентов газового топлива с учетом перехода в продукты сгорания влаги, содержащейся в топливе и окислителе
![]() ,
,
где dг − влагосодержание газового топлива, г/м3 сухого газа.
Если в вышеприведенных формулах принять =1, то определяются теоретические значения выхода продуктов полного сгорания топлива, при этом в продуктах сгорания отсутствует кислород, а объем продуктов сгорания, м3/кг (м3/м3), равен
![]() .
.
Выход сухих трехатомных продуктов полного сгорания топлива не зависит от численного значения .
Температура газов после камеры сгорания определяется из уравнения теплового баланса камеры сгорания, МДж/кг (МДж/м3),
![]() ,
,
где
![]() .
.
В явном виде уравнение баланса камеры сгорания не решается, так как входящие в это уравнение теплоемкости продуктов сгорания сами являются функцией температуры Тксг. Определить Тксг можно, используя метод последовательных приближений или графоаналитический метод. В последнем случае Тксг определяется следующим образом.
Из уравнения теплового баланса находят
 ,
,
иначе
![]() .
.
Запишем эту зависимость в виде системы двух функций:


Рис. 39. Графоаналитический метод определения Тксг
Решение задачи относительно Тксг сводится к нахождению условия, при котором у1 = у2. Значения у1 и у2 рассчитываются не менее чем по трем значениям Тксг, близким к ожидаемому. Пример графического решения задачи по определению Тксг приведен на рис. 39.
В уравнении теплового баланса всего процесса учитываются тепловые потери в камерах сгорания и смешения. Оно имеет вид (на 1 кг или м3 топлива)
 ,
,
где Qрасп , Qв − соответственно количество теплоты, внесенное в процесс паром, используемым для распыления мазута, МДж/кг, и воздухом, используемым для разбавления продуктов сгорания, МДж/кг или МДж/м3 топлива.
Количество теплоты, внесенное в процесс воздухом, складывается из теплоты сухого воздуха и водяных паров, содержащихся в воздухе,
![]() ,
,
где
![]()
![]()
vвс − количество сухого воздуха, необходимое для разбавления продуктов сгорания, м3/кг (м3/м3) топлива;
свс, сН2О − средние в интервале температур от 273 до Тв теплоемкости сухого воздуха и водяных паров, МДж/(м3К).
Энергоноситель в данном случае представляет собой смесь продуктов полного сгорания топлива, полученных при =1, избыточного количества сухого окислителя, воздуха, вводимого в процесс при разбавлении продуктов сгорания топлива, и водяных паров, содержащихся в избыточном окислителе и воздухе. Поэтому его энтальпия, МДж/кг (МДж/м3),
![]() .
.
Энтальпия
теоретического количества продуктов
сгорания топлива в энергоносителе
![]() ,
МДж/кг (МДж/м3),
рассчитывается по формуле
,
МДж/кг (МДж/м3),
рассчитывается по формуле
![]() ,
,
где с![]() допускается принять равной с
допускается принять равной с![]() .
.
Величина (-1)
Н![]() −
энтальпия избыточного (сверх теоретически
необходимого) количества окислителя,
поступающего с дымовыми газами из камеры
сгорания в камеру смешения
−
энтальпия избыточного (сверх теоретически
необходимого) количества окислителя,
поступающего с дымовыми газами из камеры
сгорания в камеру смешения
![]() ,
,
где сок,
с![]() − средние в интервале температур от
273 до Тэ,
К, объемные теплоемкости соответственно
сухого окислителя и водяных паров,
МДж/(м3К).
− средние в интервале температур от
273 до Тэ,
К, объемные теплоемкости соответственно
сухого окислителя и водяных паров,
МДж/(м3К).
Энтальпия воздуха в камере смешения Нв, МДж/м3, рассчитывается при Тэ, К,
![]() .
.
Подставив в
уравнение теплового баланса найденные
и заданные значения параметров, следует
определить v![]() и удельный расход воздуха, необходимый
для разбавления продуктов сгорания,
м3/кг
(м3/м3),
и удельный расход воздуха, необходимый
для разбавления продуктов сгорания,
м3/кг
(м3/м3),
![]() .
.
Определение расхода топлива В производится путем решения уравнения материального баланса процесса получения заданного количества энергоносителя после камеры смешения, выраженного через объемные расходы составляющих отходящих газов.
Секундный расход энергоносителя, м3/с, определяется по формуле
![]() ,
,
где V![]() −
секундный расход продуктов сгорания,
м3/с,
образующихся при сжигании В с коэффициентом
расхода окислителя =1;
−
секундный расход продуктов сгорания,
м3/с,
образующихся при сжигании В с коэффициентом
расхода окислителя =1;
Vок изб, Vв − секундные расходы соответственно избыточного окислителя и воздуха, м3/с.
Все указанные расходы могут быть выражены через расход топлива:
![]()
![]()
где V![]() − расход избыточного сухого окислителя,
м3/с;
− расход избыточного сухого окислителя,
м3/с;
V![]() − объем водяных паров в избыточном
окислителе, м3/с,
− объем водяных паров в избыточном
окислителе, м3/с,
![]()
![]()
![]()
При известном (по заданию) Vэ и найденных Vкгс, Vок изб и Vв определяется секундный расход топлива, необходимый для получения заданного количества энергоносителя.
Секундный расход окислителя, м3/с, определяется по найденному В
![]()
Суммарный объем продуктов сгорания равен 100 %, тогда процентный состав продуктов сгорания, % об., равен

В результате разбавления продуктов сгорания воздухом в энергоносителе увеличивается количество азота, кислорода и водяных паров. Их определяют по формулам, м3/кг (м3/м3) топлива.

Общий выход энергоносителя
![]()
Состав энергоносителя, % об., определяется по формулам

