
- •Выполнить до 27 ноября Сделать конспект от руки в тетради раздела «Основы цитологии»
- •1.1. Многообразие органического мира и комплекс биологических наук
- •1. Общие сведения
- •2. Предмет и задачи общей биологии
- •3. Значение биологии
- •1.2. Биологические системы и их свойства
- •1. Понятие биологической системы
- •2. Критерии биологических систем
- •Глава 2. Химическая организация жизни
- •2.1. Элементарный и молекулярный состав живого вещества
- •1. Сравнение элементарного состава живой и неживой природы
- •2. Характеристика органогенных элементов
- •3. Молекулярный состав живого вещества
- •2.2. Неорганические вещества
- •1. Типы связей между атомами, играющие важную роль в живых организмах
- •2. Содержание воды в клетке
- •3. Структура и свойства молекулы воды
- •4. Биологическое значение воды
- •2.3. Минеральные соли и их биологическая роль
- •1. Содержание солей в клетке
- •2. Биологическое значение катионов
- •3. Биологическое значение анионов
- •1. Органические вещества живой материи
- •Содержание липидов в клетке и в организме
- •3. Строение и свойства липидов
- •4. Классификация липидов
- •5. Биологические функции липидов
- •2. Содержание углеводов в живой материи
- •3. Классификация углеводов и их свойства
- •4. Биологические функции углеводов
- •2.4.3. Белки, их строение и свойства
- •1. Белки, их содержание в живом веществе и молекулярная масса
- •2. Белки – непериодические полимеры. Строение и свойства аминокислот
- •Образование пептидной связи
- •3. Первичная, вторичная, третичная и четвертичная структуры белка
- •4. Классификация белков
- •2.4.4. Биологические функции белков
- •1. Денатурация и другие свойства белков
- •2. Биологические функции белков
- •2.4.5. Нуклеиновые кислоты
- •1. Содержание в клетке, размеры молекул и молекулярная масса
- •Пиримидиновые основания
- •Пуриновые основания
- •3. Соединение нуклеотидов в цепь
- •Образование первичной структуры днк
- •4. Образование двухцепочечной молекулы днк
- •Сахарофосфатный остов днк
- •5. Правила Чаргаффа. Сущность принципа комплементарности
- •2.4.6. Классы клеточных рнк и их функции. Различия днк и рнк
- •1. Рнк и ее значение
- •2. Классы клеточных рнк и их функции
- •3. Отличия молекул днк и рнк
- •Строение клетки
- •1. Типы клеточной организации
- •2. Цитоплазма. Строение и функции оболочки
- •2. Органоиды клетки
- •3. Строение и функции ядра клетки
- •Глава 5. Воспроизведение клеток
- •5.1. Жизненный (клеточный) цикл
- •5.2. Деление клетки
- •5.2.1. Амитоз
- •5.2.2. Митоз
- •5.2.3. Мейоз
- •Вопросы к зачету по дисциплине «биология» для студентов 1 курса фармацевтического факультета
- •Контрольные тесты Химический состав клетки
- •Синтез белков
- •Эукариотическая клетка
3. Структура и свойства молекулы воды
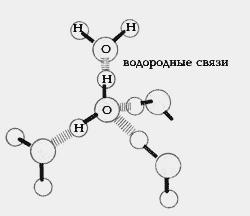
Уникальные свойства воды объясняются структурой ее молекул и определяют ее биологические функции. Формула молекулы воды состоит из двух атомов водорода и одного атома кислорода и при этом электронейтральна. Но электрический заряд внутри молекулы распределен неравномерно: в области атомов водорода (точнее протонов) преобладает положительный заряд, в области, где расположен кислород, выше плотность отрицательного заряда. Следовательно, частица воды – диполь.
Вследствие того, что электронные облака атомов водорода в молекуле воды оттянуты к атому кислорода, ядра водородных атомов способны взаимодействовать с неподеленными парами электронов атомов кислорода соседних молекул воды, т.е. между молекулами воды образуются водородные связи. Каждая молекула воды имеет два атома водорода и две неподеленные пары электронов, значит она может образовывать водородные связи с четырьмя соседними молекулами воды.
Таким образом, молекулы воды соединяются в удвоенные, утроенные и так далее ассоциированные молекулы (гидраты). В итоге, в жидком состоянии вода состоит из отдельных молекул и ассоциантов типа (Н2О)х. Способность молекул воды к образованию водородных связей друг с другом существенно влияет на физические свойства этого вещества. Большая теплоемкость, теплота плавления и теплота парообразования воды объясняются тем, что большая часть поглощаемого тепла расходуется на разрыв водородных связей между молекулами.
Вода обладает высокой теплопроводностью. Она практически не сжимается и прозрачна в видимом участке спектра. Наконец, вода – вещество, плотность которого в жидком состоянии больше, чем в твердом (при 4 °С вода имеет максимальную плотность, у льда плотность меньше, поэтому он поднимается на поверхность).
Физические и химические свойства делают воду уникальной жидкостью и определяют ее биологическое значение.
4. Биологическое значение воды
Роль воды в клетках и в организмах велика. Рассмотрим ее биологические функции, исходя из физических и химических свойств этого уникального вещества.
1. Вода способна к когезии, т.е. к сцеплению своих молекул под действием сил притяжения. Вода способна слипаться сама с собой и с другими веществами (можно, например, воду налить в стакан «с верхом» и она не прольется). Это возможно благодаря поверхностному натяжению воды, из-за которого ее поверхность как бы покрыта «кожицей». Эти физические особенности воды позволяют ей выполнять важную биологическую функцию – определение физических свойств клетки: ее объема и упругости (тургесцентностъ). У круглых червей вода полостной жидкости играет роль гидростатического скелета, выполняя опорную функцию.
2. Способность воды к адгезии. Ее свойство притягиваться любой поверхностью, несущей электрический заряд, позволяет ей подниматься по мелким порам в почве и по сосудам ксилемы у растений на большую высоту.
 Структура
воды
Структура
воды
3. Силы сцепления между молекулами воды обеспечивают ее вязкость, поэтому вода является смазывающим веществом в биологических системах. Например, синовиальная жидкость в суставах позвоночных.
4. Вода – хороший растворитель ионных (полярных), а также некоторых неионных соединений, в молекулах которых присутствуют заряженные (полярные) группы. Любые полярные соединения в воде гидратируются (окружаются молекулами воды), при этом молекулы воды участвуют в образовании структуры молекул органических веществ. Если энергия притяжения молекул воды к молекулам какого-либо вещества больше, чем энергия притяжения между молекулами самого вещества, то вещество растворяется в воде. По отношению к воде различают: гидрофильные вещества (от греч. гидрос – вода и филео – любить), хорошо растворимые в воде, и гидрофобные вещества (от греч. гидрос и фобос – страх), практически нерастворимые в воде.
В молекулах гидрофильных веществ преобладают полярные группы (–ОН; С=О; –СООН; –NH2), которые способны устанавливать с молекулами воды водородные связи. Гидрофильными свойствами обладают соли, кислоты, щелочи, белки, углеводы.
Гидрофобные вещества имеют неполярные молекулы, которые отталкиваются молекулами воды. В воде не растворяются жиры, бензин, полиэтилен и другие вещества.
Свойство воды как растворителя имеет большое значение для живых организмов, так как большинство биохимических реакций может идти только в водном растворе. Кроме того, в качестве растворителя вода обеспечивает как приток веществ в клетку, так и удаление из нее продуктов жизнедеятельности.
5. Подвижность молекул воды объясняется тем, что водородные связи, связывающие соседние молекулы, слабы, что и приводит к постоянным столкновениям ее молекул в жидкой фазе. Молекулярная подвижность воды позволяет осуществляться осмосу (диффузии, направленному движению молекул через полупроницаемую мембрану в более концентрированный раствор), необходимому для поглощения и движения воды в живых системах.
6. Среди самых распространенных в природе жидкостей вода имеет наибольшую теплоемкость, поэтому у нее высокая температура кипения (100°С) и низкая температура замерзания (0 °С). Подобные свойства воды позволили ей стать главной составляющей внутриклеточных и внутриорганизменных жидкостей. Правда, температура замерзания воды несколько выше, чем было бы идеально для жизни, так как на Земле обширные территории имеют температуры ниже 0 °С. Если кристаллы льда образуются в живом организме, то они могут разрушить его тонкие внутренние структуры и вызвать его гибель. У озимой пшеницы, у ряда насекомых, у лягушек в организме есть природные антифризы, предотвращающие образование льда в их клетках.
7. «Необычная» плотность и «поведение» воды вблизи точки замерзания приводят к тому, что лед плавает на поверхности водоемов, создавая изолирующий слой, который при низких температурах защищает водных обитателей и водоем от полного промерзания.
8. Вода обладает большой удельной теплотой парообразования, поэтому, испаряясь, вода способствует охлаждению тела (при испарении 1 г воды тело теряет 2430 Дж энергии). Известно, что за день тяжелой работы человек теряет до 10 л пота. Если бы пот во время работы не выделялся и не испарялся, то организм «нагрелся» бы до 100 С. Испарение воды с поверхности листьев растений в ходе транспирации также способствует охлаждению.
9. Вода является реагентом во многих химических реакциях. Например, гидролитическое расщепление белков, углеводов, жиров и т.д. Вода играет роль источника кислорода, выделяемого при фотосинтезе, и водорода, который используется для восстановления продуктов ассимиляции углекислого газа.
10. Большая теплоемкость и теплопроводность воды способствует равномерному распределению тепла в клетке и в организме.
Таким образом, вода – самая удивительная жидкость на Земле, свойства которой превосходят всякую фантазию. Уникальные свойства воды позволяют ей выполнять не менее уникальные биологические функции.
