
- •Физико-химические основы процесса высокотемпературной конверсии природного газа.
- •2. Стадии процесса
- •3. Образование свободного твёрдого углерода (сажи).
- •4. Использование теплового потенциала процесса.
- •5. Интенсивность процесса.
- •6. Инструкция по работе с программой
- •6.1. Исходные данные
- •6.2. Результаты расчета
- •6.3. Порядок действий для запуска программы расчета
- •Литература
- •Исходные данные для расчёта
- •Результаты расчёта.
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ РОССИЙСКОЙ ФЕДЕРАЦИИ
РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ НЕФТИ И ГАЗА
им. И.М. ГУБКИНА
__________________________________________________________________
Кафедра Газохимии
СОСНА М.Х., ЭВЕНЧИК Н.С., СМИРНОВ С.А.
Методические указания по выполнению лабораторных работ
Расчет процесса высокотемпературной конверсии метана.
Под редакцией профессора Лапидуса А.Л.
МОСКВА - 2008
УДК
Сосна М.Х., Эвенчик Н.С., Смирнов С.А.: Методические указания: «Расчет процесса высокотемпературной конверсии природного газа».
/ Под ред. А.Л. Лапидуса. – М.: РГУ нефти и газа, 2008. - 26 с.
В методических указаниях по выполнению лабораторных работ: «Расчет процесса высокотемпературной конверсии природного газа».
дана методика проведения лабораторных работ по курсу «Технология производства синтез-газа»: изложены краткие теоретические сведения по методам получения синтез-газа, приведены принципы расчета, схема процесса, инструкция по работе с программой.
Методические указания предназначены для студентов РГУ нефти и газа им. И.М. Губкина направления 655000 «Химическая технология органических веществ и топлива» (дипломированные специалисты), специальность 2504 «Химическая технология природных энергоносителей и углеродных материалов», направления 550800 «Химическая технология и биотехнология (бакалавры), программа 550801 «Химия и технология продуктов основного органического и нефтехимического синтеза» и 550809 «Химическая технология топлив и газа» (магистры).
Издание подготовлено на кафедре «ГАЗОХИМИИ».
Методические указания одобрены к изданию учебно-методической комиссией факультета химической технологии и экологии
Рецензент
д.т.н., проф.
Лыков О.П.
Российский государственный университет нефти и газа им. И.М. Губкина, 2008
Содержание
|
стр. |
Введение……………………………………………………………………. |
4 |
|
5 |
2. Стадии процесса………………………………………………………….. |
8 |
3. Образование свободного углерода (сажи)………………..…………… |
9 |
4. Использование теплового потенциала процесса….…………………… |
10 |
5. Интенсивность процесса……………………………………………..…. |
10 |
6. Инструкция по работе с программой…………………………………… |
11 |
6.1 Исходные данные ………………………………..…………………….. |
11 |
6.2. Результаты расчета .…………………………………………………… |
12 |
6.3. Порядок действий для запуска программы………………………….. |
12 |
Литература …………………………………………………………………. |
13 |
Приложения………………………………………………………………….. |
14 |
Введение Промышленный процесс высокотемпературной конверсии природного газа как способ получения синтез-газа для производства аммиака, метанола, компонентов моторных топлив, альдегидов и других соединений получил широкое распространение во многих странах. Примером тому являются фирмы «Тексако — Кемико» (США), «Шелл» (Англия — Голландия), «Монтека- тини» (Италия), которые с некоторыми различиями в технологическом и аппаратурном оформлении разработали и применяют данный вид конверсии в широких масштабах.
Основными преимуществами метода, обеспечившими его конкурентоспособность с другими способами производства синтез- газа для химических синтезов, являются[1]:
1) возможность проведения процесса без участия катализатора;
2) возможность использования в качестве сырья как углеводородных газов, так и жидких нефтепродуктов (от бензина до мазута);
3) меньшая требовательность к качеству сырья по сравнению с каталитическими процессами конверсии природного газа;
4) участие в процессе меньших объемов реагирующих веществ по сравнению с каталитической конверсией.
5) высокая интенсивность и относительная простота аппаратурного оформления.
Развитию этого метода конверсии углеводородов способствуют успехи, достигнутые в производстве кислорода и в автоматизации технологических процессов.
Физико-химические основы процесса высокотемпературной конверсии природного газа.
Высокотемпературная конверсия природного газа- его неполное горение в кислороде, проводимое в свободном объеме в отсутствие катализатора. Проведение реакции в отсутствие катализатора обеспечивается высокой температурой, равной 1350—1450 °С и давлением до 30—35 кгс/см2. При этом происходит неполное окисление метана и других углеводородов кислородом до CO и H2. Примерный состав газа, получаемого при высокотемпературной кислородной некаталитической конверсии метана: 3-4% CO2, 36—38% CO, 57-59%H2,0,2—0,4%CH4,2%N2. Недостатком процесса является необходимость использования кислорода и возможность образования сажи. Для автотермичности процесса при указанных температурах соотношение кислорода к углеводороду необходимо несколько повышать по сравнению со стехиометрическим коэффициентом, в результате чего в продуктах реакции появляются двуокись углерода и водяной пар. Обязательным условием проведения адиабатического процесса, частным случаем которого является автотермическая конверсия, является равенство сумм энтальпий входящих и выходящих из установки конверсии технологических потоков.
В первом приближении высокотемпературную конверсию природного газа можно выразить уравнениями:
![]() кДж/моль
кДж/моль
![]() кДж/моль
кДж/моль
![]() кДж/моль
кДж/моль
![]() кДж/моль
кДж/моль
При выборе этих реакций учтены возможности выделения свободного углерода, наличия непрореагировавшего метана и установления равновесия водяного газа.
Как видно из приведенных выше тепловых эффектов реакции, общий процесс конверсии природного газа эндотермичен.
Необходимое количество тепла обеспечивается введением в зону реакции кислорода или обогащенного им воздуха. Достижение температуры 1350-1450°С связано с необходимостью полного сжигания части газа с дополнительным расходом кислорода выше стехиометрического для протекания реакций неполного горения. Для сокращения объема полностью сжигаемого газа, уменьшения расхода кислорода и улучшения показателей процесса в целом применяют предварительный подогрев исходных компонентов. Обычно природный газ подогревают в огневых подогревателях до температуры около 500° С.
Путём взаимодействия кислорода с частью природного газа и подогрева исходной смеси газов повышается температура исходного потока и изменяется состав газа на входе в высокотемпературный реактор. За счет этого тепла происходит процесс конверсии углеводородов в высокотемпературном реакторе.
Необходимое количество кислорода, обеспечивающее требуемые температуру, и метана в сухом конвертированном газе определяется из теплового баланса реактора:
![]() ,
,
где:
![]() - энтальпии входного потока газа, потока
кислорода и потока газа на выходе
реактора соответственно;
- энтальпии входного потока газа, потока
кислорода и потока газа на выходе
реактора соответственно;
![]() - потери тепла.
- потери тепла.
Для определения количества вводимого кислорода необходимо рассчитывать равновесный состав выходящего газового потока.
Зависимости констант равновесия от температуры приведены ниже:
Для реакций конверсии метана:
KP1 = exp[ c1 · ln(T) +1/T · (c2 + c3 · T + c4 · T 2 + c5 · T 3 + c6 · T 4)]
c1 = -0.768535 ; c2 = 4943.27 ; c3 = -1.5062 ;
c4 = 30.101 · 10-4 ; c5 = -9.6605 · 10-7 ; c6 = 1.475 · 10-10;
Для обратной реакции водяного газа:
![]() ;
;
![]()
![]() ;
;
![]() ;
;
![]() ;
;
![]() ;
;
![]() ;
;
![]() ;
[2]
;
[2]
По данному алгоритму создана программа расчёта процесса высокотемпературной конверсии метана. Результаты расчёта по данной программе хорошо совпадают с результатами, приведенными в [3].
Описание программы и результаты расчёта приведены далее.
Схема газовых потоков в процессе высокотемпературной конверсии приведена на рис. 1.
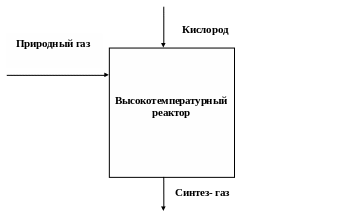
Рисунок 1. Схема газовых потоков процесса высокотемпературной конверсии углеводородов.
Процесс высокотемпературной конверсии углеводородов может быть осуществлен при различных давлениях. Неполное горение метана сопровождается увеличением объема, поэтому применение давления должно препятствовать полному окислению метана; например, при 20 am и 1204°С равновесное содержание метана составляет 0,4%, в то время как при атмосферном давлении этому содержанию метана соответствует температура около 927° С. Однако при более высоких температурах и соответственно больших значениях соотношения О2:СН4 давление существенно не влияет на окисление метана. [1]
В промышленности обычно применяют давление около 30 am. Применение повышенного давления на стадии конверсии углеводородов позволяет значительно снизить энергозатраты, например: при синтезе аммиака ( при давлении конверсии 30 am затраты энергии на сжатие конвертированного газа до давления синтеза аммиака ( ~ 320 am) сокращаются примерно на 40% ).
Повышенное давление позволяет гораздо полнее использовать тепловой потенциал процесса вследствие улучшения условий теплопередачи и повышения степени утилизации тепла. Появляется возможность использования тепла конденсации почти всего количества водяных паров, содержащихся в газовой смеси, вследствие более высокого их парциального давления и соответственно повышенной температуры конденсации. .
С повышением давления уменьшаются габариты аппаратуры, а также коммуникаций. В этом отношении процесс высокотемпературной конверсии углеводородов имеет преимущество перед каталитической, так как в нем реализуется почти вдвое меньший объем реагирующих веществ.
Промышленные технологические схемы конверсии под давлением включают следующие основные стадии:
1) предварительный подогрев исходных компонентов;
2) конверсию газа;
3) использование (отвод) тепла;
4) очистка и охлаждение конвертированного газа.
Предшествующей стадией являются производство и компримирование кислорода, а также компримирование углеводородного газа (в основном природного), если давление его в газовой магистрали недостаточно. [1]
