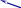- •§ 1. Оксиды и оксокислоты азота
- •§ 2. Гипоазотистая ( азотноватистая) кислота
- •Транс-форма
- •2.1 Строение:
- •Более характерны восстановительные свойства
- •§ 3. Сопоставление строения и свойств
- •Строение
- •Свойства hno2 и hno3
- •Нитраты в пище
- •§ 4. Взаимодействие hno3 с металлами.
- •Термодинамический прогноз
- •Эксперимент
- •Факторы, влияющие
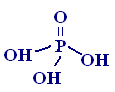
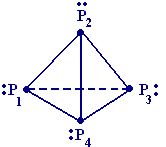
- •§ 5. Оксокислоты фосфора (моноядерные)
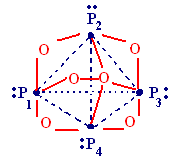
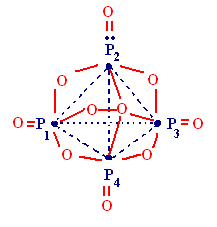
- •§ 6. Высшие (многоядерные) оксокислоты
- •Строительные единицы:
- •Мостиковые трехмерные
- •6.2. Переход
- •§ 7. Оксокислоты As, Sb, Bi.
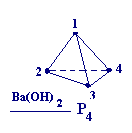
§ 5. Оксокислоты фосфора (моноядерные)
СО |
Строение |
рКа 1 = = logKa |
2P4 + 3Ba(OH)2 + 6H2O = 2PH3 + + 3Ba(H2PO2)2 P4 + H2O ⇄ PH3 + H3PO2 |
3 |
|
|
H2SO4
Ba(H2PO2)2
O2
PH3
H3PO2 |
0 |
|
|
|
+1 |
гипофосфористая |
1.2 |
|
+3 |
фосфористая |
1
Cl2 SO2 |
P4О6
H3PO3
H2O
O2 |
+5 |
ортофосфорная |
2.15 |
P4О10
H3PO4
H2O |
H3PO2 + Cu2+ Cuo (Cu+) + H3PO4
+ Ag+ Ago + H3PO4 (быстро)
2
белый Ag

3. H3PO4 + Ag+ (Cu2+) не реагирует
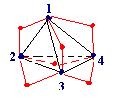
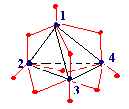
§ 6. Высшие (многоядерные) оксокислоты
фосфора.
Строительные единицы:
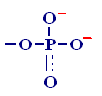
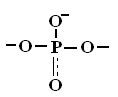
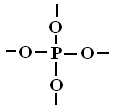
К
Мостиковые
одномерные (цепочечные)
Мостиковые
одномерные (цепочечные)Мостиковые трехмерные
6.2. Переход
Р4 Р4О6 Р4О10
О2
О2
недост.

избыток
+Н2О
Н2О
toC


[H3O+] +Н2О
[H3O+] +Н2О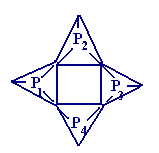
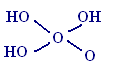

Н2О
toC
Н2О 300-1200oC
H3PO4
Полифосфаты [PnO3n
+ 1]
(n
+ 2)
Метафосфаты
(НРО3)n
n
= 3 – 6
H4P2O7
– пирофосфорная
кислота
n <
16
n =2
§ 7. Оксокислоты As, Sb, Bi.
|
+1 |
|
+3 |
|
+5 |
Азот N |
N2O (HON)2 |
N2O3
HNO2 |
|
|
N2O5
HNO3 |
Фосфор P |
H[H2PO2]
3+ As
+ 3OH |
P2O6
H3PO3 |
pK
= 1.8 |
|
P4O10
(HPO3)n
H3PO3 |
Мышьяк As |
HAsO2
+ H2O
H+
+ AsO2
|
As4O6
As(OH)3 |
pK
= 2.3 |
|
As4O6
H3AsO4 |
Сурьма Sb |
|
Sb2O3
Sb2O3
nH2O |
|
Sb2O5
H[Sb(OH)6] |
|
Висмут Bi |
|
Bi2O3
Bi(OH)3 |
|
|
KBiO3 |
сила кислот ; окислительная способность;
термическая прочность