
- •§ 1. Оксиды и оксокислоты азота
- •§ 2. Гипоазотистая ( азотноватистая) кислота
- •Транс-форма
- •2.1 Строение:
- •Более характерны восстановительные свойства
- •§ 3. Сопоставление строения и свойств
- •Строение
- •Свойства hno2 и hno3
- •Нитраты в пище
- •§ 4. Взаимодействие hno3 с металлами.
- •Термодинамический прогноз
- •Эксперимент
- •Факторы, влияющие
- •§ 5. Оксокислоты фосфора (моноядерные)
- •§ 6. Высшие (многоядерные) оксокислоты
- •Строительные единицы:
- •Мостиковые трехмерные
- •6.2. Переход
- •§ 7. Оксокислоты As, Sb, Bi.
Лекция 21. Строение и реакционная способность оксокислот элементов 15-ой группы
§ 1. Оксиды и оксокислоты азота
Таблица 1. Оксиды и оксокислоты азота.
СО |
Оксиды |
Оксокислоты |
Соли |
+1 |
Н2О
не идет
+
H2SO4
закись
азота |
Гипоазотистая к-та
азотноватистая |
Na2N2O2 |
+2 |
оксид
азота (II)
|
[H4N2O4]
нитроксиловая
к-та |
Na4N2O4 |
+3 |
трехокись
азота
+
Н2О |
H
азотистая
к-та |
NaNO2 |
+4 |
N
+
Н2О |
|
|
+5 |
+
Н2О
H2O
(Р2О5)
|
HNO3 |
KNO3 K3NO4 |
§ 2. Гипоазотистая ( азотноватистая) кислота
HON = NOH.
Транс-форма
2.1 Строение:
рКa ~ 7
Более характерны восстановительные свойства
3+ _
2.4. Получение: а)2 NaNO2 + [H] Na2O2 (AgON)2
HCl
(HON)2 N2O + H2O (разлагается)
эфир,
безв.
 б)
Н2N–OH
+ HNO2
(HON)2
+ Н2О
б)
Н2N–OH
+ HNO2
(HON)2
+ Н2О
§ 3. Сопоставление строения и свойств
HNO2 и HNO3
3.1 Получение Ba(NO2)2 + H2SO4 = 2 HNO2 + BaSO4
2 NaNO3, тв + H2SO4, конц = 2HNO3 + Na2SO4
Задача: Получить HNO3 из воздуха.
Строение
3+ HNO2
(газ)
5+ HNO3(газ)
1.49Å
1.18
111о
1.21
1.40Å
130о
114о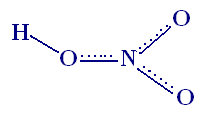









a)
В HNO2
есть
несвязывающая электронная пара.
b)
Длина связи O
– N
в HNO2
больше, чем в HNO3.
с)
l
(N=O)
< l
(HO–N)
-
N
 *+
e
*+
e2s
2p
O*
sp2
2s
2p



 NO2
NO2



 2O4
2NO2
2O4
2NO2


 N2O3
N2O3