
- •§ 1. Электронная конфигурация и свойства атомов
- •§ 2. Строение и физические свойства простых веществ.
- •2.1. Схема mo молекулы n2
- •2 Разр
- •Энергии связей ( кДж / моль )
- •Белый фосфор тетраэдры
- •§ 3. Химические свойства простых веществ.
- •Фосфорноватистая кислота
- •§ 4. Химическое связывание молекулярного азота
- •А.Е. Шилов
- •§ 5. Гидриды элементов va подгруппы
- •5.2. Особенности геометрии и физические свойства
- •Черно-красное вещество
- •§ 4. Гидриды азота
- •Гидразин (диамид)
- •Строение и внутренняя конверсия
- •Получение
- •4.4. Ослабление основных свойств
- •Диаграмма Фроста
Лекция 20. Химия элементов Va подгруппы
Пниктогены: Р – phosphorus, N – nitrogen.
§ 1. Электронная конфигурация и свойства атомов
1. |
Заряд ядра |
7N |
15P |
33As |
51Sb |
83Bi |
|||||||||||
2. |
Электронная конфигурация |
s
p
n |
|||||||||||||||
* Г
3. |
z
z
z
Bi
Sb
As
P
N
N
N
P
As
Sb
Sb
Bi***
Bi***
As
P
N
Sb
Bi
As
P
N
4.
5.
I
Э
=
Э++
е' +
I
Э
+е'
=
Э
+
E |
||||||||||||||||
6*** |
Характерные степени окисления |
|
3;0; +3; +5 |
+ |
0 ;+3;+5 |
0 |
|||||||||||
7* |
Координаци-онные числа (К.Ч.) |
4 |
4 ; 5; 6 |
4; 5; 6 |
4 ; 5; 6 |
4 ; 5; 6 |
|||||||||||
Релятивистский эффект (Hg, Te, Pb, Bi)
m =

При V c m > mo; m = 1.2mo для z ~ 80,
так как V z.
ze2
4o
۰mV2
 3.
г = и 6s
орбиталь сжимается.
3.
г = и 6s
орбиталь сжимается.
§ 2. Строение и физические свойства простых веществ.
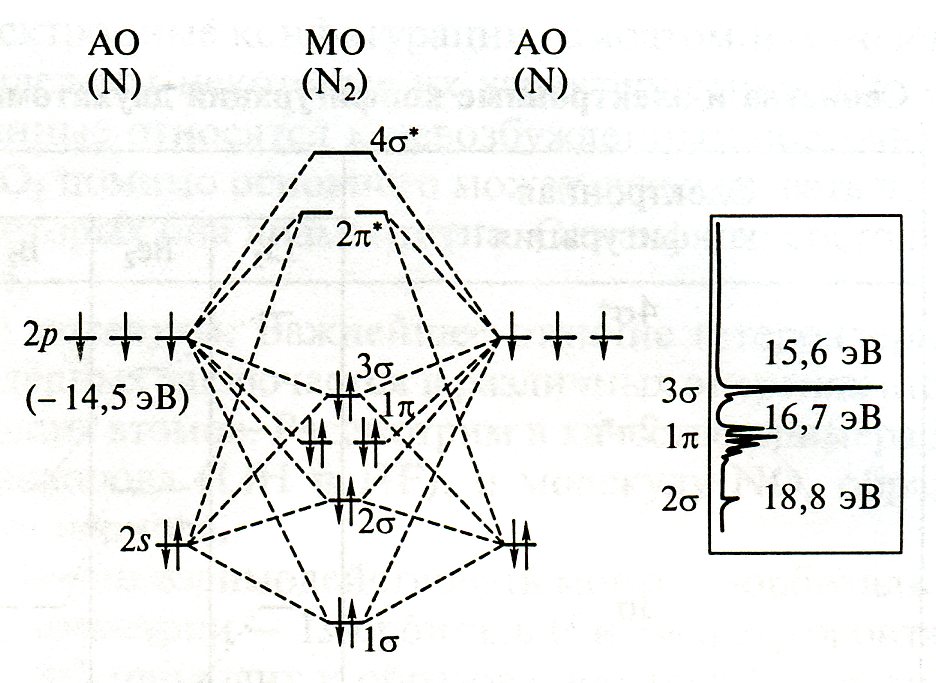
2.1. Схема mo молекулы n2
Е2 Разр
![]()


I
2рх
2ру
2рz
2р








![]() ;
;
![]()



![]()




![]()





II
2s
2s
![]()
N2
N
N
й
 ф
ф
Порядок
связи (П.С.) =
![]()

Детектор










Io
К








h



Е
А2
А1
А1





 А
А
h
= энергия связи
+
кинетическая энергия![]() +
+
Схема получения фотоэлектронного спектра
Энергии связей ( кДж / моль )
E(Э–Э) кДж/моль
200
P–P



N–N
146
160
As–As
Sb–Sb
11

|
N |
P |
C |
Э – Э |
160 |
200 |
346 |
Э = Э |
418 > 2 х 160 |
310 < 2 x 200 |
600 < 2 х 346 |
Э Э |
942 |
480 < 3 x 200 |
835 < 2 x 346 |
Вывод: 1. Азот образует двойные и тройные связи.
2. Фосфор образует цепи Р – Р – Р –
Структура.
1.
Р – Р – Р = 60О
2.
Химическая связь за счет
3s-орбиталей
(~80%)
3p-орбиталей(~20%)
3.
Доказательства: а) PES
b)
нет
Р8
Р



Р

Р
Р



 s2
, np3
a)
b) As3d10
s2
, np3
a)
b) As3d10























 3;
0; +3; +5
3;
0; +3; +5
 3;
+ 5
3;
+ 5
 ;+3
;+3