
1и 2)ферменты: все ферменты делятся на шесть классов по типу катализируемой реакции.
1. Оксиредуктазы ускоряют окислительно-восстановительные реакции, осуществляя перенос электронов или атомов водорода (е- + H+) от окисляемого субстрата (донора водорода) к акцептору, который при этом восстанавливается. Биохимическое окисление органических соединений происходит путем их дегидрирования. Процесс этот катализирует оксиредуктазы, носящие название дегидрогеназ. Первичные дегидрогеназы в качестве кофермента чаще всего имеют никотинамид-адениндинуклеотид (НАД). В сочетании с различными белковыми носителями НАД образует множество ферментов, действующих на определенные вещества. В общем виде реакцию дегидрирования можно записать так:
(органическое вещество — донор 2Н) + НАД → (окисленное органическое вещество) + НАД Н2.
Первичные дегидрогеназы называют анаэробными, так как они не могут передавать водород непосредственно кислороду. Регенерация их происходит в результате передачи атома водорода молекуле другого органического соединения или вторичной дегидрогеназе. Коферментом вторичных дегидрогеназ является флавин-аденин-динуклеотид (ФАД):
НАД Н2 + ФАД → ФАД Н2 + НАД.
Вторичные дегидрогеназы могут передавать вoдород непосредственно кислороду, поэтому называются аэробными дегидрогеназами:
ФАД Н2 + 1/2 O2 → H2O + ФАД.
Однако в большинстве случаев регенерация ФАД происходит в результате взаимодействия с ферментами цитохромной системы, состоящей из нескольких ферментов — цитохромов, в состав простетической группы которых входят атомы железа. Цитохромная система не принимает атомов водорода с ФАД Н2, но способна принимать электроны, снятые с атомов водорода. Электрон передается по цепи цитохромов за счет изменения валентности атомов железа. Последний фермент в цитохромной системе носит название цитохромоксидазы. Только он способен передавать электрон его конечному акцептору — кислороду. Одновременно через раствор передается кислороду протон.
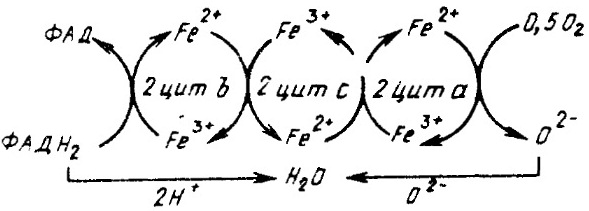
Оксиредуктазы катализируют биохимические процессы, сопровождающиеся выделением энергии.
2. Гидролазы катализируют реакции гидролитического раздржения сложных органических соединений. В общем виде реакция гидролиза вещества А1А2 записывается следующим образом:
A1A2 +
НОН![]() A1OH
+ А2Н.
A1OH
+ А2Н.
В зависимости от химической природы гидролизируемого субстрата гидролазы подразделяются на несколько групп: эстеразы ускоряют гидролитическое расщепление сложных эфиров (к этой группе относятся липазы, участвующие в гидролизе жиров); глюкозидазы катализируют гидролиз сложных углеводов; пептидазы ускоряют гидролиз пептидных связей в белковых молекулах.
3. Трансферазы ускоряют реакцию переноса молекулярных остатков и атомных групп. Ферменты этого класса подразделяются по характеру переносимой группы.
4. Лиазы — ферменты, катализирующие отщепление атомных группировок с образованием двойных связей или присоединение по месту этих связей. Одной из важнейших групп ферментов этого класса являются декарбоксилазы, с участием которых протекают реакции декарбоксилирования — отщепления СО2.
5. Изомеразы катализируют внутримолекулярные превращения, например реакции превращения одного изомера в другой.
6. Лигазы ускоряют реакции синтеза сложных органических соединений, поэтому их называют иногда синтетазами. Реакции, катализируемые ферментами этого класса, протекают сопряженно с реакциями распада АТФ. Энергия молекулы АТФ используется для активирования исходных реагирующих веществ. Эти ферменты играют значительную роль в биосинтезе белков, нуклеиновых и жирных кислот и других соединений.
Роль витамина В2 Рибофлавин является биологически активным веществом, играющим важную роль в поддержании здоровья человека. Биологическая роль рибофлавина определяется вхождением его производных флавинмононуклеотида (FMN) и флавинадениндинуклеотида (FAD) в состав большого числа важнейших оксилительно-восстановительныхферментов в качестве коферментов.
Флавиновые ферменты принимают участие в окислении жирных, янтарной и других кислот; инактивируют и окисляют высокотоксичные альдегиды, расщепляют в организме чужеродные D-изомеры аминокислот, образующиеся в результате жизнедеятельности бактерий; участвуют в синтезе коферментных форм витамина B6 и фолацина; поддерживают в восстановленном состоянииглутатион и гемоглобин.
В ферментах коферменты функционируют как промежуточные переносчики электронов и протонов, отщепляемых от окисляемого субстрата.
3)Кофермент q
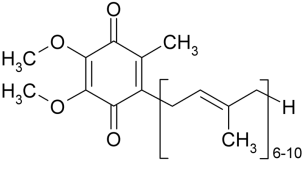 По
химической природе кофермент Q имеет
сходство в строении молекулы с
витаминами Е и К и
представляет собой
2,3-диметокси-5-метил-1,4-бензохинон с
изопреновой цепью в 6-м положении. Число
остатков изопрена в боковой цепи убихинон
в разных организмах варьируется от 6 до
10. Такие варианты кофермента Q обозначают
как Сo Q6,
Сo Q7 и т. д.
По
химической природе кофермент Q имеет
сходство в строении молекулы с
витаминами Е и К и
представляет собой
2,3-диметокси-5-метил-1,4-бензохинон с
изопреновой цепью в 6-м положении. Число
остатков изопрена в боковой цепи убихинон
в разных организмах варьируется от 6 до
10. Такие варианты кофермента Q обозначают
как Сo Q6,
Сo Q7 и т. д.
В клетках Saccharomyces cerevisiae содержится Co Q6, Escherichia coli — Co Q8, грызунов — Co Q9. В митохондриях клеток большинства млекопитающих, включая человека, встречается убихинон только с 10 изопреновыми звеньями.[1]
Кофермент Q представляет собой желто-оранжевые кристаллы без вкуса и запаха. Температура плавления 49-51° С. Растворим в диэтиловом эфире, очень слабо растворим в этаноле, практически нерастворим в воде. На свету постепенно разлагается и окрашивается. С водой образует эмульсию с концентрацией 10 %, 20 % и 40 %.
Кофермент Q принимает участие в реакциях окислительного фосфорилирования, является компонентом цепи переноса электронов в митохондриях. Ингибиторы работы убихинона останавливают реакции окислительного фосфорилирования.
Кофермент Q является компонентом цепи переноса электронов, принимает участие в переносе электронов с NADH-дегидрогеназного комплекса (комплекс I) и сукцинатдегидрогеназного комплекса (II) на комплекс III, и участвует таким образом в синтезе АТФ.
Также кофермент Q является антиоксидантом и, в отличие от других антиоксидантов, регенерируется организмом. Кроме того, кофермент Q восстанавливает антиоксидантную активность витамина Е — α-токоферола.
Антиоксидантное действие кофермента Q обусловлено главным образом его восстановленной формой (Co QH2). Активность восстановленной формы кофермента Q на три порядка выше невосстановленной. Реакцию нейтрализации свободных радикалов восстановленным коферментом Q можно записать следующим образом 2LOO• + Co QH2 → 2LООН + Co Q.
4)
ЦИТОХРОМЫ,
сложные белки (гемопротеиды),
содержащие в качестве простетич.
группы гем.
Служат переносчиками электронов в
процессах внутриклеточного дыхания,
окислит. фосфорилирования, фотосинтеза,
ферментативного гидроксилирования и
в др. биол.
окислит.-восстановит. р-циях. Цитохромы
найдены у всех животных, растений
и микроорганизмов.
Известно неск. десятков индивидуальных
цитохромов, многие из к-рых выделены в
гомогенном состоянии. Определены
первичные структуры и пространственная
организация многих цитохромов наиб.
хорошо изучены св-ва цитохрома
с.
В зависимости от природы гема цитохромы
делят на 4 группы, обозначаемые буквами
а, b, с и d. У цитохрома а гем имеет
строение протопорфирина (см.Порфирины)
и содержит формильный заместитель;
цитохром b содержит протогем
(ферропротопорфирин), нековалентно
связанный с полипептидной цепью;
уцитохрома
с боковые
заместители протопорфирина ковалентно
связаны с полипептидной цепью; у цитохрома
d гем представлен
дигидропорфирином (хлорином). Атом Fe,
входящий в состав гемов цитохромов
и подвергающийся окислению и восстановлению,
координирован 4 связями с атомами N
порфириновых колец и 2 - с лигандами,
принадлежащими полипептидным цепям
(остатки гистидина, цистеина).
Нек-рые цитохромы содержат неск.
одинаковых или разных гемов.
Все
цитохромы ярко окрашены и имеют
характерные спектры поглощения света
в видимой области, меняющиеся при
их окислении или восстановлении.
В типичном спектре имеются три основные
полосы поглощения![]() полосы
в порядке убывания длин волн), по изменению
к-рых обычно судят о степени восстановленности
цитохрома.
Донорами электронов для
цитохромов обычно служат флавины, гидрохиноны,
железо-серные белки или
другие цитохромы; акцепторами - другие
цитохромы или кислород (цитохромоксидазы).
Нек-рые цитохромы (цитохромоксидаза,
цитохром Р-450) прочно связаны
с мембранами митохондрий,
микросом (липопротеидные комплексы) и
не раств. в воде,
другие (напр., цитохром
с)
раств. в ней.
Цитохромы
реагируют с лигандами,
конкурирующими с естественным координац.
окружением атома Fe гемов (СО, анионы азида, цианида и
др.). Связывание этих лигандов приводит
к изменению спектральных св-в и инактивации
цитохромов.
полосы
в порядке убывания длин волн), по изменению
к-рых обычно судят о степени восстановленности
цитохрома.
Донорами электронов для
цитохромов обычно служат флавины, гидрохиноны,
железо-серные белки или
другие цитохромы; акцепторами - другие
цитохромы или кислород (цитохромоксидазы).
Нек-рые цитохромы (цитохромоксидаза,
цитохром Р-450) прочно связаны
с мембранами митохондрий,
микросом (липопротеидные комплексы) и
не раств. в воде,
другие (напр., цитохром
с)
раств. в ней.
Цитохромы
реагируют с лигандами,
конкурирующими с естественным координац.
окружением атома Fe гемов (СО, анионы азида, цианида и
др.). Связывание этих лигандов приводит
к изменению спектральных св-в и инактивации
цитохромов.
