
- •Применение теории активированного комплекса для расчета константы скорости химической реакции
- •I. Теоретическое введение
- •II. Экспериментальная часть
- •2.1. Изучение строения и свойств переходного состояния
- •2.2. Идентификация переходного состояния. Построение сечения ппэ по координате реакции
- •2.3. Расчет константы скорости
- •Литература
2.2. Идентификация переходного состояния. Построение сечения ппэ по координате реакции
Для того чтобы узнать, какой реакции соответствует переходное состояние, необходимо провести его идентификацию. Используется метод Intrinsic Reaction Coordinate (IRC), позволяющий осуществлять спуск из седловой точки к исходным веществам и продуктам вдоль пути реакции. При этом можно проследить, как меняется геометрия АК на всём пути реакции. Примеры релаксации находятся в файлах rel_1.out – rel_6.out в той же папке «Задача ТАК» на Рабочем столе.
Сначала необходимо определить файлы релаксации, соответствующие рассмотренному ранее в п. 2.1. переходному состоянию. Визуализацию следует проводить с помощью использованной ранее программы «QCC Front End». Открывая в ней файлы rel_1.out – rel_6.out, переключаясь стрелкой вниз по шагам релаксации (IRC), проследите за изменением геометрии структуры. Найдите два нужных файла релаксации.
С помощью этих файлов постройте сечение ППЭ вдоль пути реакции, то есть зависимость энергии системы от координаты реакции E(s). Для этого откройте последовательно выбранные вами файлы в программе «Блокнот» rel_х.out (в сторону реагентов) и rel_y.out (в сторону продуктов), где x, y – номера нужных файлов. С помощью программы «Блокнот» скопируйте находящиеся в конце файла значения s, E(s)-E(0) (рис. 2), перенесите их в программу EXСEL и постройте зависимость E(s)-E(0) от s. Необходимо объединить информацию двух файлов rel_x.out и rel_y.out в одном графике зависимости E(s)-E(0) от s, а числовые данные перевести в кДж/моль (1 ат.ед.=627,5095 ккал/моль=2625,5000 кДж/моль).
После копирования данных в программу EXСEL возникнет необходимость разбить их на несколько столбцов. Для этого воспользуйтесь сервисом в меню «Данные» / «Разбить по столбцам».
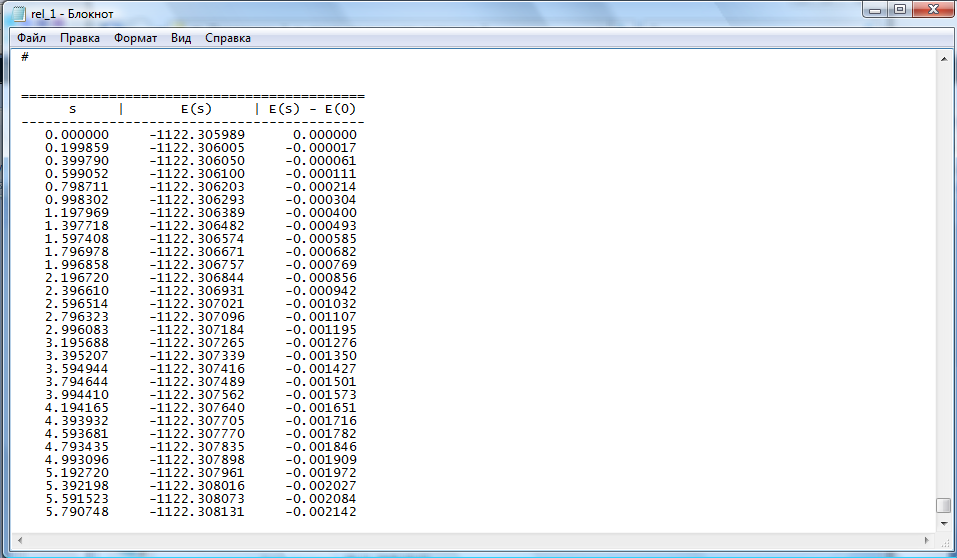
Рис. 2 Вид окна программы «Блокнот» с необходимыми данными для построения сечения ППЭ, s – координата реакции, E(s) – значение энергии в ат.ед.
Задание:
Зарисуйте структуры продуктов и реагентов, соответствующие переходному состоянию, подпишите расстояния и углы. Сравните геометрические параметры переходного состояния и продуктов, реагентов.
Постройте сечение ППЭ по координате реакции.
Оцените значение энергии активации EТАК и энтальпии реакции H.
Вопросы:
Что называется координатой реакции?
Зачем проводят релаксацию переходного состояния?
Почему каждому переходному состоянию соответствуют два файла релаксации?
Чему соответствуют четыре остальных файла релаксации?
2.3. Расчет константы скорости
На заключительном этапе требуется рассчитать константу скорости реакции
PhCH2CH=CH2 ↔ PhCH=CHCH3 (I)
по уравнению (2). Для этого заполните таблицу 1 результатами расчета энергии и термодинамических функций для всех участников реакции. Это можно сделать, открыв последовательно каждый файл I.out (реагент), TS.out (переходное состояние), P.out (продукт), например, с помощью программы «Блокнот». В конце файла Вы увидите необходимую информацию. Из термодинамических поправок и логарифма статистической суммы выпишите только суммарное их значение “total”.
Таблица 1. Данные выходных файлов для участников реакции: Е – полная энергия, Е0 – энергия с учетом энергии нулевых колебаний, lnQ – логарифм статистической суммы, Т =298К.
Участник реакции |
E, ат.ед. |
E0, ат.ед. |
lnQ |
GT –G0, кДж/моль |
HT –H0, кДж/моль |
ST, кДж/моль |
Исходное соединение (I) |
|
|
|
|
|
|
Переходное состояние (ПС) |
|
|
|
|
|
|
Продукт (P)
|
|
|
|
|
|
|
На основе данных таблицы 1 рассчитайте энергию активации ТАС и константу скорости реакции (I). Используйте соотношения (3) и (2). Пользуясь данными таблицы 1, рассчитайте стандартные энтропию, энтальпию и изменение энергии Гиббса в реакции (I).
Полученные значения представьте в виде таблицы 2.
Таблица 2. Константа скорости, энергия активации, изменения термодинамических функций реакции.
ЕТАК, кДж/моль |
кДж/моль |
кДж/моль |
Дж/мольК |
k, с-1 |
|
|
|
|
|
Вопросы:
Для данной реакции зависит ли предэкспоненциальный множитель в уравнении 2 от температуры?
Нужно ли знать значение статистической суммы продукта для расчета константы скорости по уравнению ТАК?
Как логарифмы статистических сумм связаны с термодинамическим функциям
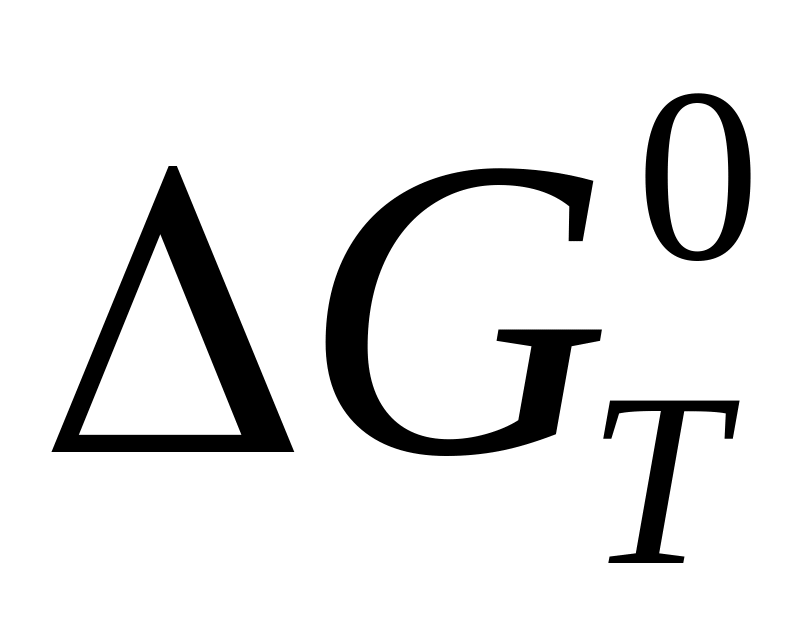 ,
,
 ,
,
 для химической реакции?
для химической реакции?Сравните по возможности полученные значения с экспериментальными данными (Т =298К)
(аллилбензол ↔ транс-β-метилстирол) = -23,3 ± 0,5 кДж/моль
(аллилбензол ↔ цис-β-метилстирол) = -12,3 ± 0,6 кДж/моль.
